Методы исследования в травматологии и ортопедии
Вперёд: http://healthy-back.livejournal.com/231878.html
Назад: http://healthy-back.livejournal.com/231254.html
К содержанию: http://healthy-back.livejournal.com/228626.html
Компьютерная томография обеспечивает отличную визуализацию в поперечной (аксиальной) плоскости. В настоящее время КТ в значительной степени заменила традиционную томографию. КТ часто используют как рутинное дополнение к обычному рентгенографическому исследованию при травмах и заболеваниях позвоночника, таза, запястья, голеностопных суставов и стопы, а также при исследованиях опухолей костей и мягких тканей.
Магнитно-резонансная томография в последние годы оказала существенное воздействие на лучевое исследование опорно-двигательной системы. Несмотря на то, что при МРТ невозможно непосредственно визуализировать корковую кость, этот метод обеспечивает наилучшую визуализацию мягких тканей и костного мозга по сравнению с другими применяющимися сегодня методиками визуализации. Мышцы, жир, жидкость, сухожилия, связки и хрящи хорошо видны и дифференцируются друг от друга на МР-изображеииях.
При исследованиях травматических, опухолевых и воспалительных поражений скелета и мягких тканей чрезвычайно полезны импульсные последовательности с подавлением сигнала от жира (например, инверсия-восстановление с коротким временем 1 или ЅТІК) в сочетании с Т1-взвешенной последовательностью после внутривенного контрастирования соединениями гадолиния.
Ультрасонография обычно применяется для исследований мягких тканей опорно-двигательной системы. Это доступное, недорогое и быстро осуществимое исследование можно применять у детей и младенцев.
Показания для сонографического обследования постоянно расширяются и включают в себя:
- оценку суставной нестабильности (например, при дисплазии тазобедренного сустава);
- суставной выпот, различная локализации гематом;
- повреждения суставов, сухожилий и связок;
- обнаружение инородных тел в мягких тканях, особенно осколков стекла и кусков дерева, не обнаруживаемых при рентгенографии;
- контроль за выполнением тонкоигольной аспирации и биопсии.
Для исследования сосудистого русла и скорости кровотока (артериального и венозного) используется допплеровский сканер. Его действие основано на физическом явлении, называемом допплеровским эффектом, согласно которому частота восприятия звука, издаваемого движущимся объектом, изменяется при её восприятии неподвижным приёмником.
Наиболее часто используются дуплексные сканеры, которые объединяют в себе ультрасонографию в режиме реального времени и импульсную допплеровскую сонографию. При перемещении электронного курсора вручную параллельно направлению потока крови автоматически измерястся допплеровский угол и показывается истинная скорость потока. При измерении в поперечном сечении сосуда можно также рассчитать и объёмные показатели потока крови (например, в мл/с).
Цветовая визуализация кровотока - дальнейшее развитие дуплексного сканирования. Цвета накладываются на изображение в β-режиме в масштабе реального времени, показывая наличие перемещающейся крови. Неподвижные ткани показываются оттенками серой шкалы, а сосуды - цветной (оттенками голубого, красного, жёлтого, зеленого, определяемыми относительной скоростью и направлением потока). Такое цветное изображение даёт хорошее представление о наличии различных сосудов и потоков крови, но обеспечиваемая данным методом количественная информация менее точна, чем при постоянноволновом или импульсном допплєровском исследовании. Поэтому цветная визуализация кровотока всегда комбинируется с импульсной допплеровской сонографией и цветное изображение используют как хорошее подспорье при выборе контрольного объёма для импульсного допплеровского режима.
Лучевая ангиология (Ангиоло́гия - раздел медицины, изучающий кровеносные и лимфатические сосуды - H.B.) и лучевая сосудистая хирургия выросли в обширную дисциплину, развивающуюся на стыке медицинском радиологии и хирургии.
Успехи этой дисциплины связаны с четырьмя факторами:
1) лучевому исследованию доступны все артерии, все вены и венозные синусы, все лимфатические пути;
2) для изучения сосудистой системы могут быть использованы все лучевые методы - рентгенологический, ультразвуковой, радионуклидный, магнитнорезонансный, термографический, а это создаёт возможность сопоставления их данных, при котором они взаимно дополняют друг друга;
3) лучевые методы обеспечивают сопряжённое исследование морфологии сосудов и кровотока в них; (Морфоло́гия (в биологии) изучает как внешнее строение (форму, структуру, цвет, образцы) организма, таксона или его составных частей, так и внутреннее строение живого организма (например, морфология человека) - H.B.)
4) под контролем лучевых методов могут осуществляться различные лечебные манипуляции на сосудах (рентгеноэндоваскулярные вмешательства), представляющие собой альтернативу хирургическим операциям при ряде патологических состояний сосудов.
Наиболее частым объектом лучевого исследования бывают грудная часть аорты с её брахноцефальными ветвями, аортоподвздошный и бедренно-подколенный отделы артериальной системы, глубокие вены нижних конечностей.
Компьютерная и магнитно-резонансная томография
Развитие научно-технического прогресса способствует разработке и внедрению в клиническую практику новых высокоинформативннх методов лучевого исследования, поднявших на новый качественный уровень диагностику различных заболеваний органов и систем. На основе достижений точных наук, были разработаны и созданы установки для рентгеновской КТ и МРТ, эмиссионной и позитронной томографии, высокотехнологичные аппараты для УЗД.
Среди лучевых методов диагностики особое место занимает рентгеновская КТ, которая на современном этапе развития получила широкое применение в медицинской практике и стала неотъемлемой частью диагностического исследования многих органов и систем при изучении их патологических изменений.
КТ - метод послойного рентгенологического исследования органов и тканей, позволяющий измерять плотность любого участка исследуемых объектов. Она основана на компьютерной обработке множественных рентгеновских изображений поперечного слоя, выполненных под разными углами.
В 1963 г. А. Cormak в университете Тафта (США) рассчитал взаимодействие узко направленного пучка рентгеновского излучения с веществом головного мозга и опубликовал статью о возможности компьютерной визуализации его структуры.
Независимо от А. Cormak аналогичные исследования проводила группа инженеров английской фирмы электромузыкальных инструментов во главе с G. Hounsfild. Первые результаты экспериментальных исследований по применению компьютерного томографа были доложены J. Ambrose на ежегодном конгрессе британских радиологов в 1972 г. В 1979 г. А. Cormak и G. Hounsfild были удостоены Нобелевской премии.
Быстрое техническое совершенствование компьютерных томографов значительно повысило эффективность и разрешающую способность метода, а также сократило время сканирования пациентов. Время сканирования первого объекта на созданной G. Hounsfild экспериментальной установке составило 9 ч.
В настоящее время, используя спиральную КТ, можно проводить непрерывное объёмное сканирование 30-40 см. анатомического пространства при задержке дыхания, что обеспечивает чёткое дифференцирование минимального патологического очага (опухоли, метастазы, переломы и др.) и постановку правильного диагноза уже через несколько секунд от начала исследования.
Принципиальное отличие КТ от традиционной рентгенодиагностики состоит в том, что КТ-изображение не является результатом принятого излучения, а является конечным продуктом вычислений, производимых компьютером. В связи с этим КТ имеет ряд особенностей, которые следует учитывать в практической деятельности:
1) КТ-изображение не имеет теней и помех от неоднородности тканей, содержащихся в других слоях исследуемого отдела, а также не зависит от порядка расположения тканей с различной рентгеновской плотностью;
2) изображение, полученное при КТ, представляет собой массив цифровых данных в виде пространственного распределения величин коэффициентов ослабления в тканях исследуемого слоя, поэтому субъективная визуальная оценка изображения дополнена прямой денситометрией;
3) высокая точность измерений позволяет отдифференцировать отдельные органы и ткани, отличающиеся друг от друга по плотности в пределах 0,5%; в связи с этим считается, что объём информации, содержащийся в компьютерной томограмме, примерно в 1000 раз больше, чем в обычной рентгенограмме.
За нулевую величину плотности принята плотность воды. Плотность кости приравнена к + 1000 усл. ед., а воздуха - к 1000 усл. ед., обозначаемых буквой Н (по имени Hounsfild). Таким образом, согласно этой шкале (шкала Хаунсфилда), весь диапазон плотностей тела человека состоит из 2000 ед. - от - 1000 до + 1000. Исходя из этого, для каждого органа выбран средний показатель его плотности, т.е. коэффициент абсорбции.
Нередко нормальные и патологические ткани практически не отличаются друг от друга по рентгеновской плотности. В таких случаях применяется методика усиления контрастности КТ-изображений. Усиление производят путём внутривенного введения трийодированного вещества, которое при наличии патологической сосудистой сети или нарушении гематоэнцефалического барьера накапливается в патологической ткани.
Современный томограф снабжён пакетом программ, которые обеспечивают всесторонний анализ получаемой информации:
- получение гистограмм,
- выделение зоны интереса,
- проведение измерений изображения,
- построение на основе поперечных томограмм реконструированных многоплоскостных изображений, в том числе двух- и трёхмерных изображений. Также изображение может быть получено на плёнке либо записано на магнитные носители.
Значение КТ не ограничивается её использованием для диагностики заболеваний. Под контролем КТ производят пункции и прицельные биопсии различных органов и патологических очагов. КТ играет важную роль в контроле за консервативным и хирургическим лечением больных.
Наиболее часто КТ используют при ЧМТ и травме спинного мозга. Основной особенностью КТ-исслсдования пациентов с ЧМТ является требование проведения диагностики в максимально короткие сроки без дополнительной травматизации пациента. Поэтому врач выбирает такие техничсские условия, которые обеспечат минимальное время сканирования.
Иногда приходится проводить томографию «толстыми» срезами, сознательно пренебрегая детальной информацией о костях основания черепа, чтобы успеть получить достаточное представление о состоянии головного мозга и его оболочек. При двигательном беспокойстве пациента перед исследованием необходимо провестн соответствующую премедикацию.
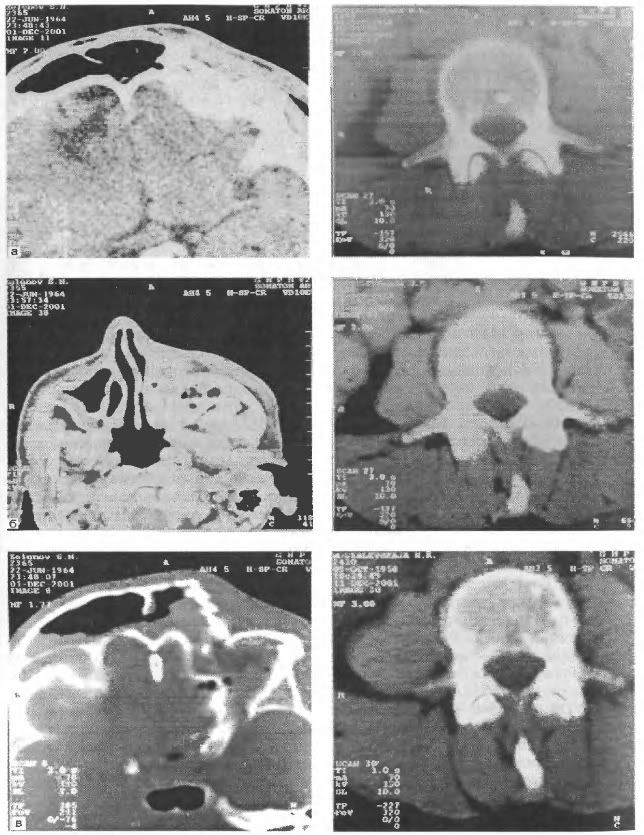
Информативность КТ в выявлении переломов костей свода черепа, за исключением вдавленных, относительно невелика и составляет всего 42% в сравнении с рутинным краниографическим исследованием. Однако, при КТ гораздо чаще выявляются переломы костей основания черепа. При этом помимо прямого признака нарушения целости кости - линии перелома - определяются косвенные признаки - скопление крови в воздухоносных пазухах, наличие в полости черепа пузырьков воздуха - пнемоцефалия (если КТ проводилась до спинномозговой пункции) (рис. 54).
Рис. 54. Компьютерные томограммы.
а - перелом стенки верхнечелюстной пазухи, гомосинус;
б - оскольчатый перелом скулоорбитального комплекса, пневмоцефалия;
в - контузионный очаг в левой лобной доле.
Острые эпи- и субдуральные гематомы представляют собой однородные высокоплотные (60-70 ед. Н) зоны, отличающиеся друг от друга лишь но форме. При значительном объёме гематомы сопровождаются отёком вещества мозга в поражённом полушарии и смещением срединных структур в сторону, противоположную кровоизлиянию.
Хронические гематомы чаще бывают неоднородной структуры, имеют низкоплотностные участки (20-30 ед. Н) и оболочку гематомы, которая хорошо прослеживается с 3-й недели после травмы.
Субарахноидальные кровоизлияния также характеризуются наличием сгустков крови в субарахноидальных пространствах и повышением плотности цистерн мозга.
Характерными признаками внутримозговых высокоплотностных (70-80 ед. Н) гематом, располагающихся, как правило, в коре головного мозга, являются наличие узкой полоски экстравазата плазмы, отошедшего из сгустка крови в процессе его ретракции, и незначительная выраженность или даже полное отсутствие отёка поражённой области мозга.
Контузионные очаги делят на локальный отёк с низкой плотностью (около 24 ед. Н) и геморрагическую контузию с более высокой плотностью (37-43 ед. Н) (рис. рис. 54, в).
Тяжёлые повреждения оболочек и вещества головного мозга часто сопровождаются увеличением его объёма. При этом на компьютерных томограммах отмечаются уменьшение объёма ликворных пространств и исчезновение нормального рисунка борозд и извилин мозга.
Целями любого диагностического исследования при травме спинного мозга являются:
- обнаружение переломов позвонков,
- определение их формы,
- наличия смещения самих позвонков и их фрагментов,
- определение характера сочетанного поражения связочного аппарата и окружающих тканей,
- оценка степени деформации позвоночного канала,
- сдавления спинного мозга, а также
- степени поражения вещества спинного мозга и его корешков.
При отсутствии неврологической симптоматики обычная рентгенография продолжает оставаться основным методом обследования больных при острой травме спинного мозга. Однако, использование КТ является эффективным в идентификации деталей переломов, переломов со смещением или отрывом корковых фрагментов, визуализации острых интрамедуллярных кровоизлияний. В оценке указанных изменений возможности КТ выше, чем рентгенографии и МРТ.
Высокая разрешающая способность и возможность визуализации межмышечных жировых прослоек делают КТ одним из ведущих методов в диагностике повреждений мягких тканей. При оценке изображений КТ необходимо сравнивать поражённую конечность со здоровой, особенно при малых размерах изменений.
Использование КТ для диагностики заболеваний суставов ограничено и рекомендуется лишь в трудных диагностических случаях. Наиболее полную информацию о суставах можно получить с помощью МРТ, которая всё шире используется в артрологии.
В настоящее время можно смело сказать, что МРТ достаточно прочно вошла в клиническую практику, превратившись из нестандартного метода исследования с неотчётливыми показаниями к его применению (начало 80-х годов прошлого века) в целую область радиологии. К середине 9О-х годов прошлого века накоплен огромный клинический опыт использования МРТ и уже сложились определённые представления о целесообразности использования МРТ в зависимости от наличия тех или иных изменений.
В 1946 г. Феликс Блох из Стенфордского университета и Ричард Пурселл из Гарварда независимо друг от друга открыли и обосновали эффект ядерного магнитного резонанса, за что в 1952 г. были удостоены Нобелевской премии. В 1977 г. Раймонду Дамадьяну удалось получить первые МР-изображения человека. Однако, серийное производство МР-установок началось только в 1982 г. Парк МР-томографов рос достаточно быстро. Так, в 1982 г. в мире было только три МР-томограФа, пригодных для клинических исследований, в 1993 г.- около 6500, а в 1994 г.- уже 9000. Ежегодно вводится в эксплуатацию около 1500 новых МР-установок. В настоящее Время в западно-европейских странах, в Японии и США насыщенность МР-томографами составляет один аппарат на каждые 100 000 жителей.
В нашей стране первый МР-томограф был установлен в 1984 г. в Институте кардиологии КНЦ АМН. Если к началу 1995 г. в России было около 70 МР-установок, в том числе значительное число систем со сверхпроводящими магнитами, то к концу ХХ в. - более 100.
Поскольку к моменту появления МРТ КТ уже прочно заняла лидирующее положение среди других методов диагностики, то внедрение МРТ во многом определялось тем, насколько она эффективнее КТ при том или ином патологическом состоянии. Если в первые годы становления МРТ этот метод рассматривали как дополняющий данные КТ, то сейчас в нейродиагностике, а также при некоторых заболеваниях опорно-двигательной системы МРТ заняла лидирующее положение.
В большинстве случаев диагностические возможности МРТ не уступают возможностям КТ. Бурное развитие в последние годы спиральной КТ может внести некоторые коррективы в отношении показаний и приоритетности томографических исследований. Поэтому в данной области ещё имеется ряд нерешённых или спорных вопросов. Вместе с тем МРТ продолжает бурно развиваться, приборы становятся экономичнее, более удобными в обращении, улучшается качество изображений и программного обеспечения, а также сокращается время исследования. Поэтому время от времени статус метода возрастает, а показания к его использованию расширяются.
Метод МРТ основан на том, что некоторые атомные ядра содержат нечётное число протонов (1Н, 23Na, 31Р, 13С, 13F и пр.), которые обладают магнитным моментом - спином, которому соответствует магнитный диполь. В результате взаимодействия магнитных диполей и внешнего магнитного поля происходит вращение спинов вдоль направления силовых линий поля с частотой, пропорциональной напряжённости магнитного поля. Ядра атомов поглощают энергию внешнего электромагнитного радиочастотного излучения при условии совпадения его частоты с частотой процессии ядер. Это явление и носит название ЯМР.
В МРТ сигналы ядерной индукции используются для получения изображения структур организма человека. Для этого на постоянное магнитное поле накладываются более слабые градиентные поля, частота резонанса ядер начинает зависеть от их пространственных координат, в результате чего возбуждение ядер происходит только в одном срезе, ориентацию и расположение которого выбирает врач. МР-изображения получаются путём математической обработки сигналов ядерной индукции вследствие наложения полей различных радиочастотных импульсных последовательностей. МР-иэображения представлены в различных оттенках серой шкалы. Характер сигнала определяется рядом параметров основными из которых являются:
1) время спин-решёточной релаксации Тл;
2) время спин-спиновой релаксации Т2;
3) протонная плотность - количество протонов на единицу плотности;
4) движение или диффузии исследуемых структур.
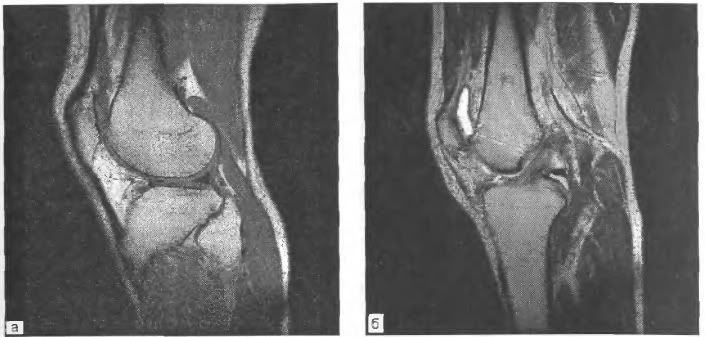
В МРТ имеются различные импульсные последовательности (ЅЕ - спин-эхо, ІК - инверсия - восстановление, градиентное эхо и др.), которые в зависимости от поставленной задачи позволяют получать оптимальный контраст между изменёнными и нормальными тканями (рис. 55).
Рис. 55. Сагиттальное МР-изображение коленного сустава.
а - Т1-взвешенное;
б - Т2-взвешенное.
Бурно развивающееся направление - МРТ с контрастированием. В первые годы развития МРТ считали, что применение контрастирующих агентов излишне, так как метод МРТ сам по себе достаточно информативен. В дальнейшем было обнаружено, что применение МР-контрастирующих средств в значительном мере увеличивает объём получаемой диагностической информации.
Контрастирующие МР-препараты изменяют магнитные свойства тканей. По своим свойствам они делятся на
- парамагнетики (соединения гадолиния) и
- суперпарамагнетики (соединения железа),
а по своему действию на контрастность изображения подразделяются на
- позитивные и
- негативные агенты.
Позитивные агенты повышают интенсивность сигнала за счёт укорочения релаксации Т1, к ним относятся большинство парамагнетиков.
Негативные агенты понижают интенсивность сигнала за счёт укорочения времени релаксации Т2, как правило, этими свойствами обладают суперпарамагнетики.
В настоящее время в клинической практике используют низкомолекулярные внеклеточные парамагнитные контрастирующие средства для внутривенного введения на основе гадолиния (магневист, омнискан, дотарем) и суперпарамагнитные соединения оксида железа в качестве пероральных контрастирующих средств (абдоскан, люмирем).
Диагностика травматических поражений с помощью МРТ - сложная и трудоёмкая задача. Часто из-за ряда причин (критическое состояние пациента, требующее использования реанимационного оборудования для поддержания жизненных функций, вынужденное положение, иммобилизующие шины и пр.) проведение МРТ становится невозможным. В острой стадии травмы МРТ имеет довольно ограниченное значение из-за относительной длительиосги исследования, а также в связи с низкой чувствительностью метода при диагностике острых гематом и повреждений костей.
Существенно повышается значение МРТ при обследовании пациентов в подострой и хронической стадиях травмы спинного мозга. Этому способствуют многопроекционность томографии с демонстрацией больших по протяжённости участков позвоночника и спинного мозга, возможность визуализации труднодоступных для других методов отделов позвоночника (краниовертебральная область, верхнегрудной отдел позвоночника). Сопутствующие травме позвоночника и спинного мозга отёк, очаги миеломаляции и некроза лучше определяются на Т2-взвешенных изображениях как области повышения интенсивности МР-сигнала (рис. 56).
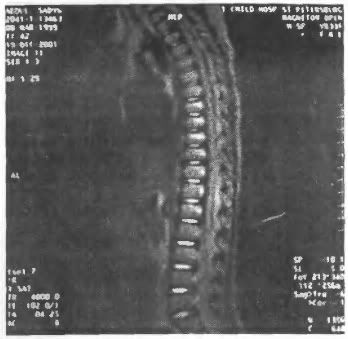
Рис. 56. Компрессионный перелом тел позвонков Т7-Т11.
Особенно полезной следует считать МРТ при оценке состояния суставов, а также оценке последствий спинальной травмы. Без эндолюмбального использования контрастирующих препаратов при МРТ можно визуализировать состояние вещества спинного мозга, изменение его размеров и формы, атрофические изменения диффузного или локального характера, выявлять ликворные кисты и гидромиелитические полости.
К основным достоинствам метода относятся
- неинвазивность,
- отсутствие лучевой нагрузки (безвредность),
- 3-мерный характер получаемых изображений,
- естественный контраст от движущейся крови,
- отсутствие артефактов от костей,
- высокая дифференциация мягких тканей,
- возможность выполнения спектроскопии для прижизненного изучения метаболизма тканей in vitro.
Радионуклидные исследования
Наиболее значимые этапы радионуклидной диагностики скелета связаны применением в качестве метки её метаболических процессов нуклида 47Са (50-е годы прошлого века) и 85Ѕr (60-е годы прошлого века) как химического аналога кальция. Их основными недостатками являлся довольно длительный период полураспада (физическая величина, строго постоянная для каждого радионуклида, отражающая время, за которое произойдет распад половины имеющихся нестабильных атомов конкретного химического элемента, так, например, для 85Ѕr он ранен 64 дням) и относительно высокая энергия γ-излучения. Но при этом необходимо отметить и главное их достоинство - фармакокинетика указанных радионуклидов полностью отражала процессы метаболизма основного элемента минерального компонента костной ткани - кальция.
В 1971 г.в журнале «Nuclear medicine» было опубликовано первое сообщение о применении полифосфата, меченного метастабильным нуклидом 99mТс, в качестве нового остеотропного РФП. Главными достоинствами его являлись низкая энергия γ-излучения и короткий период полураспада (6,1 ч). Но при этом необходимо отметить, что практически всё последующее время идет дискуссия - что является главным акцептором данного РФП и какие именно процессы метаболизма им индицируются.
Тем не менее радионуклидная диагностика заболеваний и повреждений скелета сегодня входит в число методов, без которых трудно представить современную ортопедию и травматологию.
Суть радионуклидной диагностики скелета, как, впрочем, и любого другого органа и ткани, - радиометрия с помощью высокочувствительных радиометрических устройств. Совершенствование их детекторных блоков (сцинтилляционных датчиков), включение в комплексы мощной вычислительной техники уже привели к тому, что суммарная лучевая нагрузка, являющаяся главным поводом для ограничений в использовании источников ионизирующего излучения, стала не только сравнимой с таковой при традиционной рентгенографии, но и в ряде случаев даже меньше последней.
Главным приёмом в оценке результатов радионуклидной диагностики скелета является сравнение показателей накопления РФП в исследуемой поражённой области и в аналогичной интактной. Следует помнить, что сравнение значений фактически зарегистрированных γ-квантов осуществляется с учётом времени экспозиции и величины площади «зоны интереса». Среди основных вариантов различия указанных показателей к двум основным относятся повышенное и пониженное накопление РФП. Достоверным считается различие более 20%, но опытные специалисты при работе на высокочувствительной аппаратуре снижают этот порог и до 10%.
Необходимо отметить и ещё два встречающихся на практике варианта - ложноположительный и ложно-отрицательный. Поэтому результаты радионуклидной диагностики скелета должны стоять в ряду других сведений о больном как часть комплексной диагностики, приводящей в своей совокупности к правильному диагнозу и соответственно - к корректной лечебной тактике.
Суть радиодиагностической процедуры іn vivо крайне проста: в организм человека вводят РФП с последующей внешней радиометрией γ-квантов, выделяющихся при его физическом распаде. Абсолютно ясно, что эти γ-кванты выделяются с момента приготовления РФП.
Поскольку при проведении радиодиагностических процедур в ортопедии и травматологии самый популярный метод введения остеотропного РФП - внутривенный, то первый блок получаемой информации о состоянии опорно-двигательного аппарата будет отражать характеристику сосудистого русла в интересующей зоне, или области. Размеры этой области определяются только фактическими размерами сцинтилляционного кристалла натрия йодида в детекторе гамма-камеры.
Если радиометрия начинается за несколько секунд до введения препарата, а в этом нет никакой сложности, то врач получает возможность наблюдать весь процесс поведения РФП в сосудистом русле: от первичного прохождения в нём его болюса до равномерного распределения, которое наступает через несколько минут.
В результате математической обработки полученных данных в распоряжении врача оказывается график, на котором достаточно отчётливо можно видеть так называемые артериальную, венозную и смешанную фазы кровотока.
«Артериальная» фаза кровотока является результатом регистрации прохождения болюса РФП в артериях интересующей области после перехода его из вены в малый круг кровообращения и попадания в большой. Уже на этом пути происходит растворение РФП в крови, поэтому результаты радиометрии для оценки «артериальной» фазы будут зависеть от объёма, концентрации и скорости введения препарата - чем меньше его объём, выше первичная концентрация и меньше время введения, тем дальше по кровеносному руслу он будет сохранять характеристику болюса.
«Венозная» фаза кровотока может быть так названа достаточно условно, так как в результате перехода болюса РФП из артериальной сети в венозную он понесёт достаточно ощутимые потери в своей концентрации. Но, тем не менее, после «артериального» пика наблюдается снижение числа регистрируемых γ-квантов с быстрым их подъёмом вновь. Это значит, что РФП возвращается по венозной сети, что повышает концентрацию препарата в массиве интересующей области. Анализ такого повторного подъёма числа регистрируемых γ-квантов и позволяет дать характеристику состояния венозной сети.
«Смешанная» фаза наблюдается буквально через несколько минут от начала радиодиагностической процедуры. К этому моменту РФП равномерно распределяется в кровеносном русле и проводимая радиометрия отражает суммарную концентрацию препарата в артериальной, венозной и капиллярной сетях.
Следует отметить, что такая диагностика состояния сосудистого русла может проводиться и как первый этап в радионуклидном обследовании костного скелета с применением остеотропных РФП, и самостоятельно, но с использованием интактных для костей препаратов (например, пертехнетат).
К преимуществам радионуклидной диагностики состояния сосудистого русла в сравнении с рентгенологическими методами с контрастированием могут быть отнесены отсутствие противопоказаний, значительно меньшая лучевая нагрузка, отсутствие реакции сосудистой стенки, доступность для исследования практически любой области опорнодвигательного аппарата и некоторые другие. В частности, в качестве дополнительной врач может получить информацию о косвенных признаках функционального состояния почек, поскольку применяемые в ортопедии и травматологии РФП выводятся из организма именно через почки.
В сравнении с нелучевыми методами диагностики сосудистого русла (например, допплерография) данный метод также имеет определённые преимущества, важнейшим из которых является возможность визуализировать ограниченные области, или очаги, с избыточным и недостаточным кровообращением.
К недостаткам данного метода диагностики состояния кровеносного русла следует отнести отсутствие возможности детального изучения конкретных сосудов, определённую зависимость от качества выполнения радиодиагностической процедуры (исходная концентрация препарата, скорость его введения), повышенную лучевую нагрузку на критические органы, к которым относятся половые железы (из-за высокой концентрации γ-излучаюшего препарата в мочевом пузыре).
Сразу после попадания остеотропното РФП в кровеносное русло начинаются его миграция в костную ткань и выведение из организма. Не останавливаясь на детальном изложении этих процессов, можно отметить, что в радиобиологии указанные процессы подвергаются количественному анализу.
Имея в виду то, что в радионуклидной диагностике опорно-двигательного аппарата в последние десятилетия используется только короткоживущий метастабильный 99mТс, необходимо отметить, что он сам по себе не обладает остеотропностью. Остеотропность определяется его носителями, среди которых ведущими являются дифосфонаты, образующие с технецием комплексные соединения.
Именно эти соединения попадают из кровеносного русла в костную ткань, где и происходит их накопление. В первый час от начала радиодиагностической процедуры, когда ещё достаточна концентрация РФП в крови, радиометрия не позволяет достоверно дифференцировать процесс накопления препарата в скелете. Но по мере реализации двух уже упомянутых путей миграции РФП в организме - выведение из организма через почки и накопление в костях - создаются все условия для количественной оценки последнего. Поэтому на практике радиометрию скелета осуществляют в течение 4-го часа от начала диагностической процедуры. Исследование в более поздние сроки теряет смысл из-за короткого периода полураспада 99mТс.
В норме остеотропный препарат с радиоактивной меткой равномерно распределяется по всему костному скелету. У взрослых различия в количестве зарегистрированных γ-квантов незначительны для разных костей и зависят только от массы живой костной ткани в каждой конкретной области.
У детей, в отличие от взрослых, в костях имеются физиологические зоны повышенного накопления РФП. Это ростковые зоны, где бы они ни были - от метафизов длинных трубчатых костей до апофизов тел позвонков. При завершении процесса роста и закрытия ростковых зон данные физиологические области повышенной гиперфиксации РФП исчезают. Здесь можно отметить, что, по нашему опыту, количественная характеристика накопления РФП в ростковых зонах у детей не является прямым линейным отражением их ростовой активности. Так, например, наблюдалось асимметричное снижение накоплении РФП в ростковых зонах длинных трубчатых костей при длительной иммобилизации данной конечности. При этом каких-либо признаков. изменения её длины не отмечалосъ.
В результате заболевания или травмы естественным образом меняется функциональное состояние костной ткани. Вместе с ним меняется её способность акцентировать РФП. Высокочувствительная аппаратура, применяемая для выявления этого процесса, позволяет уверенно обнаруживать локальные изменения в нём и тем самым предоставляет врачу соответствующую информацию. На этом и построена идеология радионуклидной диагностики в ортопедии и травматологии.
Локальное нарушение в костной ткани может быть выявлено и другими методами лучевой диагностики. Но главное преимущество радионуклидного метода в том, что он информирует об отклонениях в её функциональном состоянии ещё до появления структуральных изменений, т.е. на дорентгенологическом этапе.
Таким образом, врач при проведении радионуклидной диагностики костного скелета определяет наличие и распространённость области в скелете с нарушенным функциональным состоянием костной ткани. К этому следует добавить, что современная аппаратура позволяет при однократном введении РФП исследовать абсолютно весь скелет, что очень выгодно при полифокальных заболеваниях.
С другой стороны, большой интерес у врача вызывает вопрос об активности патологического процесса, когда изменения структуры костной ткани налицо. Любая лучевая диагностика (рентгенография, КТ, МРТ и др.) будет отражать уже прошедшие события. Исключением из этого является радионуклидная диагностика, основанная на прижизненной индикации протекающих в данное время процессов.
Таким образом, обеспечивается второй информационный блок - сведения об активности патологического или восстановительного процесса. Именно поэтому данный метод диагностики остаётся без конкурентов при хронических вялотекущих заболеваниях. К ним относятся остеомиелиты, артриты и артрозы, замедленная консолидация и дистрофические локальные поражения костей и мн. др.
Здесь необходимо остановиться на том, о чём уже было упомянуто выше, - до настоящего времени идет дискуссия о главных «действующих лицах», участвующих в акцептировании 99mТс-дифосфоната. Без чёткого представления об этом довольно сложно представить себе суть патофизиологического процесса, характеристики распространённости и активности которого получатся без особых затруднений.
Объём главы не даёт возможностей для подробного изложения различных, порой диаметрально противоположных, точек зрения на вопрос о месте акцептирования 99mТс-дифосфоната.
Вперёд: http://healthy-back.livejournal.com/231878.html
Назад: http://healthy-back.livejournal.com/231254.html
К содержанию: http://healthy-back.livejournal.com/228626.html
Назад: http://healthy-back.livejournal.com/231254.html
К содержанию: http://healthy-back.livejournal.com/228626.html
Компьютерная томография обеспечивает отличную визуализацию в поперечной (аксиальной) плоскости. В настоящее время КТ в значительной степени заменила традиционную томографию. КТ часто используют как рутинное дополнение к обычному рентгенографическому исследованию при травмах и заболеваниях позвоночника, таза, запястья, голеностопных суставов и стопы, а также при исследованиях опухолей костей и мягких тканей.
Магнитно-резонансная томография в последние годы оказала существенное воздействие на лучевое исследование опорно-двигательной системы. Несмотря на то, что при МРТ невозможно непосредственно визуализировать корковую кость, этот метод обеспечивает наилучшую визуализацию мягких тканей и костного мозга по сравнению с другими применяющимися сегодня методиками визуализации. Мышцы, жир, жидкость, сухожилия, связки и хрящи хорошо видны и дифференцируются друг от друга на МР-изображеииях.
При исследованиях травматических, опухолевых и воспалительных поражений скелета и мягких тканей чрезвычайно полезны импульсные последовательности с подавлением сигнала от жира (например, инверсия-восстановление с коротким временем 1 или ЅТІК) в сочетании с Т1-взвешенной последовательностью после внутривенного контрастирования соединениями гадолиния.
Ультрасонография обычно применяется для исследований мягких тканей опорно-двигательной системы. Это доступное, недорогое и быстро осуществимое исследование можно применять у детей и младенцев.
Показания для сонографического обследования постоянно расширяются и включают в себя:
- оценку суставной нестабильности (например, при дисплазии тазобедренного сустава);
- суставной выпот, различная локализации гематом;
- повреждения суставов, сухожилий и связок;
- обнаружение инородных тел в мягких тканях, особенно осколков стекла и кусков дерева, не обнаруживаемых при рентгенографии;
- контроль за выполнением тонкоигольной аспирации и биопсии.
Для исследования сосудистого русла и скорости кровотока (артериального и венозного) используется допплеровский сканер. Его действие основано на физическом явлении, называемом допплеровским эффектом, согласно которому частота восприятия звука, издаваемого движущимся объектом, изменяется при её восприятии неподвижным приёмником.
Наиболее часто используются дуплексные сканеры, которые объединяют в себе ультрасонографию в режиме реального времени и импульсную допплеровскую сонографию. При перемещении электронного курсора вручную параллельно направлению потока крови автоматически измерястся допплеровский угол и показывается истинная скорость потока. При измерении в поперечном сечении сосуда можно также рассчитать и объёмные показатели потока крови (например, в мл/с).
Цветовая визуализация кровотока - дальнейшее развитие дуплексного сканирования. Цвета накладываются на изображение в β-режиме в масштабе реального времени, показывая наличие перемещающейся крови. Неподвижные ткани показываются оттенками серой шкалы, а сосуды - цветной (оттенками голубого, красного, жёлтого, зеленого, определяемыми относительной скоростью и направлением потока). Такое цветное изображение даёт хорошее представление о наличии различных сосудов и потоков крови, но обеспечиваемая данным методом количественная информация менее точна, чем при постоянноволновом или импульсном допплєровском исследовании. Поэтому цветная визуализация кровотока всегда комбинируется с импульсной допплеровской сонографией и цветное изображение используют как хорошее подспорье при выборе контрольного объёма для импульсного допплеровского режима.
Лучевая ангиология (Ангиоло́гия - раздел медицины, изучающий кровеносные и лимфатические сосуды - H.B.) и лучевая сосудистая хирургия выросли в обширную дисциплину, развивающуюся на стыке медицинском радиологии и хирургии.
Успехи этой дисциплины связаны с четырьмя факторами:
1) лучевому исследованию доступны все артерии, все вены и венозные синусы, все лимфатические пути;
2) для изучения сосудистой системы могут быть использованы все лучевые методы - рентгенологический, ультразвуковой, радионуклидный, магнитнорезонансный, термографический, а это создаёт возможность сопоставления их данных, при котором они взаимно дополняют друг друга;
3) лучевые методы обеспечивают сопряжённое исследование морфологии сосудов и кровотока в них; (Морфоло́гия (в биологии) изучает как внешнее строение (форму, структуру, цвет, образцы) организма, таксона или его составных частей, так и внутреннее строение живого организма (например, морфология человека) - H.B.)
4) под контролем лучевых методов могут осуществляться различные лечебные манипуляции на сосудах (рентгеноэндоваскулярные вмешательства), представляющие собой альтернативу хирургическим операциям при ряде патологических состояний сосудов.
Наиболее частым объектом лучевого исследования бывают грудная часть аорты с её брахноцефальными ветвями, аортоподвздошный и бедренно-подколенный отделы артериальной системы, глубокие вены нижних конечностей.
Компьютерная и магнитно-резонансная томография
Развитие научно-технического прогресса способствует разработке и внедрению в клиническую практику новых высокоинформативннх методов лучевого исследования, поднявших на новый качественный уровень диагностику различных заболеваний органов и систем. На основе достижений точных наук, были разработаны и созданы установки для рентгеновской КТ и МРТ, эмиссионной и позитронной томографии, высокотехнологичные аппараты для УЗД.
Среди лучевых методов диагностики особое место занимает рентгеновская КТ, которая на современном этапе развития получила широкое применение в медицинской практике и стала неотъемлемой частью диагностического исследования многих органов и систем при изучении их патологических изменений.
КТ - метод послойного рентгенологического исследования органов и тканей, позволяющий измерять плотность любого участка исследуемых объектов. Она основана на компьютерной обработке множественных рентгеновских изображений поперечного слоя, выполненных под разными углами.
В 1963 г. А. Cormak в университете Тафта (США) рассчитал взаимодействие узко направленного пучка рентгеновского излучения с веществом головного мозга и опубликовал статью о возможности компьютерной визуализации его структуры.
Независимо от А. Cormak аналогичные исследования проводила группа инженеров английской фирмы электромузыкальных инструментов во главе с G. Hounsfild. Первые результаты экспериментальных исследований по применению компьютерного томографа были доложены J. Ambrose на ежегодном конгрессе британских радиологов в 1972 г. В 1979 г. А. Cormak и G. Hounsfild были удостоены Нобелевской премии.
Быстрое техническое совершенствование компьютерных томографов значительно повысило эффективность и разрешающую способность метода, а также сократило время сканирования пациентов. Время сканирования первого объекта на созданной G. Hounsfild экспериментальной установке составило 9 ч.
В настоящее время, используя спиральную КТ, можно проводить непрерывное объёмное сканирование 30-40 см. анатомического пространства при задержке дыхания, что обеспечивает чёткое дифференцирование минимального патологического очага (опухоли, метастазы, переломы и др.) и постановку правильного диагноза уже через несколько секунд от начала исследования.
Принципиальное отличие КТ от традиционной рентгенодиагностики состоит в том, что КТ-изображение не является результатом принятого излучения, а является конечным продуктом вычислений, производимых компьютером. В связи с этим КТ имеет ряд особенностей, которые следует учитывать в практической деятельности:
1) КТ-изображение не имеет теней и помех от неоднородности тканей, содержащихся в других слоях исследуемого отдела, а также не зависит от порядка расположения тканей с различной рентгеновской плотностью;
2) изображение, полученное при КТ, представляет собой массив цифровых данных в виде пространственного распределения величин коэффициентов ослабления в тканях исследуемого слоя, поэтому субъективная визуальная оценка изображения дополнена прямой денситометрией;
3) высокая точность измерений позволяет отдифференцировать отдельные органы и ткани, отличающиеся друг от друга по плотности в пределах 0,5%; в связи с этим считается, что объём информации, содержащийся в компьютерной томограмме, примерно в 1000 раз больше, чем в обычной рентгенограмме.
За нулевую величину плотности принята плотность воды. Плотность кости приравнена к + 1000 усл. ед., а воздуха - к 1000 усл. ед., обозначаемых буквой Н (по имени Hounsfild). Таким образом, согласно этой шкале (шкала Хаунсфилда), весь диапазон плотностей тела человека состоит из 2000 ед. - от - 1000 до + 1000. Исходя из этого, для каждого органа выбран средний показатель его плотности, т.е. коэффициент абсорбции.
Нередко нормальные и патологические ткани практически не отличаются друг от друга по рентгеновской плотности. В таких случаях применяется методика усиления контрастности КТ-изображений. Усиление производят путём внутривенного введения трийодированного вещества, которое при наличии патологической сосудистой сети или нарушении гематоэнцефалического барьера накапливается в патологической ткани.
Современный томограф снабжён пакетом программ, которые обеспечивают всесторонний анализ получаемой информации:
- получение гистограмм,
- выделение зоны интереса,
- проведение измерений изображения,
- построение на основе поперечных томограмм реконструированных многоплоскостных изображений, в том числе двух- и трёхмерных изображений. Также изображение может быть получено на плёнке либо записано на магнитные носители.
Значение КТ не ограничивается её использованием для диагностики заболеваний. Под контролем КТ производят пункции и прицельные биопсии различных органов и патологических очагов. КТ играет важную роль в контроле за консервативным и хирургическим лечением больных.
Наиболее часто КТ используют при ЧМТ и травме спинного мозга. Основной особенностью КТ-исслсдования пациентов с ЧМТ является требование проведения диагностики в максимально короткие сроки без дополнительной травматизации пациента. Поэтому врач выбирает такие техничсские условия, которые обеспечат минимальное время сканирования.
Иногда приходится проводить томографию «толстыми» срезами, сознательно пренебрегая детальной информацией о костях основания черепа, чтобы успеть получить достаточное представление о состоянии головного мозга и его оболочек. При двигательном беспокойстве пациента перед исследованием необходимо провестн соответствующую премедикацию.
Информативность КТ в выявлении переломов костей свода черепа, за исключением вдавленных, относительно невелика и составляет всего 42% в сравнении с рутинным краниографическим исследованием. Однако, при КТ гораздо чаще выявляются переломы костей основания черепа. При этом помимо прямого признака нарушения целости кости - линии перелома - определяются косвенные признаки - скопление крови в воздухоносных пазухах, наличие в полости черепа пузырьков воздуха - пнемоцефалия (если КТ проводилась до спинномозговой пункции) (рис. 54).
Рис. 54. Компьютерные томограммы.
а - перелом стенки верхнечелюстной пазухи, гомосинус;
б - оскольчатый перелом скулоорбитального комплекса, пневмоцефалия;
в - контузионный очаг в левой лобной доле.

Острые эпи- и субдуральные гематомы представляют собой однородные высокоплотные (60-70 ед. Н) зоны, отличающиеся друг от друга лишь но форме. При значительном объёме гематомы сопровождаются отёком вещества мозга в поражённом полушарии и смещением срединных структур в сторону, противоположную кровоизлиянию.
Хронические гематомы чаще бывают неоднородной структуры, имеют низкоплотностные участки (20-30 ед. Н) и оболочку гематомы, которая хорошо прослеживается с 3-й недели после травмы.
Субарахноидальные кровоизлияния также характеризуются наличием сгустков крови в субарахноидальных пространствах и повышением плотности цистерн мозга.
Характерными признаками внутримозговых высокоплотностных (70-80 ед. Н) гематом, располагающихся, как правило, в коре головного мозга, являются наличие узкой полоски экстравазата плазмы, отошедшего из сгустка крови в процессе его ретракции, и незначительная выраженность или даже полное отсутствие отёка поражённой области мозга.
Контузионные очаги делят на локальный отёк с низкой плотностью (около 24 ед. Н) и геморрагическую контузию с более высокой плотностью (37-43 ед. Н) (рис. рис. 54, в).
Тяжёлые повреждения оболочек и вещества головного мозга часто сопровождаются увеличением его объёма. При этом на компьютерных томограммах отмечаются уменьшение объёма ликворных пространств и исчезновение нормального рисунка борозд и извилин мозга.
Целями любого диагностического исследования при травме спинного мозга являются:
- обнаружение переломов позвонков,
- определение их формы,
- наличия смещения самих позвонков и их фрагментов,
- определение характера сочетанного поражения связочного аппарата и окружающих тканей,
- оценка степени деформации позвоночного канала,
- сдавления спинного мозга, а также
- степени поражения вещества спинного мозга и его корешков.
При отсутствии неврологической симптоматики обычная рентгенография продолжает оставаться основным методом обследования больных при острой травме спинного мозга. Однако, использование КТ является эффективным в идентификации деталей переломов, переломов со смещением или отрывом корковых фрагментов, визуализации острых интрамедуллярных кровоизлияний. В оценке указанных изменений возможности КТ выше, чем рентгенографии и МРТ.
Высокая разрешающая способность и возможность визуализации межмышечных жировых прослоек делают КТ одним из ведущих методов в диагностике повреждений мягких тканей. При оценке изображений КТ необходимо сравнивать поражённую конечность со здоровой, особенно при малых размерах изменений.
Использование КТ для диагностики заболеваний суставов ограничено и рекомендуется лишь в трудных диагностических случаях. Наиболее полную информацию о суставах можно получить с помощью МРТ, которая всё шире используется в артрологии.
В настоящее время можно смело сказать, что МРТ достаточно прочно вошла в клиническую практику, превратившись из нестандартного метода исследования с неотчётливыми показаниями к его применению (начало 80-х годов прошлого века) в целую область радиологии. К середине 9О-х годов прошлого века накоплен огромный клинический опыт использования МРТ и уже сложились определённые представления о целесообразности использования МРТ в зависимости от наличия тех или иных изменений.
В 1946 г. Феликс Блох из Стенфордского университета и Ричард Пурселл из Гарварда независимо друг от друга открыли и обосновали эффект ядерного магнитного резонанса, за что в 1952 г. были удостоены Нобелевской премии. В 1977 г. Раймонду Дамадьяну удалось получить первые МР-изображения человека. Однако, серийное производство МР-установок началось только в 1982 г. Парк МР-томографов рос достаточно быстро. Так, в 1982 г. в мире было только три МР-томограФа, пригодных для клинических исследований, в 1993 г.- около 6500, а в 1994 г.- уже 9000. Ежегодно вводится в эксплуатацию около 1500 новых МР-установок. В настоящее Время в западно-европейских странах, в Японии и США насыщенность МР-томографами составляет один аппарат на каждые 100 000 жителей.
В нашей стране первый МР-томограф был установлен в 1984 г. в Институте кардиологии КНЦ АМН. Если к началу 1995 г. в России было около 70 МР-установок, в том числе значительное число систем со сверхпроводящими магнитами, то к концу ХХ в. - более 100.
Поскольку к моменту появления МРТ КТ уже прочно заняла лидирующее положение среди других методов диагностики, то внедрение МРТ во многом определялось тем, насколько она эффективнее КТ при том или ином патологическом состоянии. Если в первые годы становления МРТ этот метод рассматривали как дополняющий данные КТ, то сейчас в нейродиагностике, а также при некоторых заболеваниях опорно-двигательной системы МРТ заняла лидирующее положение.
В большинстве случаев диагностические возможности МРТ не уступают возможностям КТ. Бурное развитие в последние годы спиральной КТ может внести некоторые коррективы в отношении показаний и приоритетности томографических исследований. Поэтому в данной области ещё имеется ряд нерешённых или спорных вопросов. Вместе с тем МРТ продолжает бурно развиваться, приборы становятся экономичнее, более удобными в обращении, улучшается качество изображений и программного обеспечения, а также сокращается время исследования. Поэтому время от времени статус метода возрастает, а показания к его использованию расширяются.
Метод МРТ основан на том, что некоторые атомные ядра содержат нечётное число протонов (1Н, 23Na, 31Р, 13С, 13F и пр.), которые обладают магнитным моментом - спином, которому соответствует магнитный диполь. В результате взаимодействия магнитных диполей и внешнего магнитного поля происходит вращение спинов вдоль направления силовых линий поля с частотой, пропорциональной напряжённости магнитного поля. Ядра атомов поглощают энергию внешнего электромагнитного радиочастотного излучения при условии совпадения его частоты с частотой процессии ядер. Это явление и носит название ЯМР.
В МРТ сигналы ядерной индукции используются для получения изображения структур организма человека. Для этого на постоянное магнитное поле накладываются более слабые градиентные поля, частота резонанса ядер начинает зависеть от их пространственных координат, в результате чего возбуждение ядер происходит только в одном срезе, ориентацию и расположение которого выбирает врач. МР-изображения получаются путём математической обработки сигналов ядерной индукции вследствие наложения полей различных радиочастотных импульсных последовательностей. МР-иэображения представлены в различных оттенках серой шкалы. Характер сигнала определяется рядом параметров основными из которых являются:
1) время спин-решёточной релаксации Тл;
2) время спин-спиновой релаксации Т2;
3) протонная плотность - количество протонов на единицу плотности;
4) движение или диффузии исследуемых структур.
В МРТ имеются различные импульсные последовательности (ЅЕ - спин-эхо, ІК - инверсия - восстановление, градиентное эхо и др.), которые в зависимости от поставленной задачи позволяют получать оптимальный контраст между изменёнными и нормальными тканями (рис. 55).
Рис. 55. Сагиттальное МР-изображение коленного сустава.
а - Т1-взвешенное;
б - Т2-взвешенное.

Бурно развивающееся направление - МРТ с контрастированием. В первые годы развития МРТ считали, что применение контрастирующих агентов излишне, так как метод МРТ сам по себе достаточно информативен. В дальнейшем было обнаружено, что применение МР-контрастирующих средств в значительном мере увеличивает объём получаемой диагностической информации.
Контрастирующие МР-препараты изменяют магнитные свойства тканей. По своим свойствам они делятся на
- парамагнетики (соединения гадолиния) и
- суперпарамагнетики (соединения железа),
а по своему действию на контрастность изображения подразделяются на
- позитивные и
- негативные агенты.
Позитивные агенты повышают интенсивность сигнала за счёт укорочения релаксации Т1, к ним относятся большинство парамагнетиков.
Негативные агенты понижают интенсивность сигнала за счёт укорочения времени релаксации Т2, как правило, этими свойствами обладают суперпарамагнетики.
В настоящее время в клинической практике используют низкомолекулярные внеклеточные парамагнитные контрастирующие средства для внутривенного введения на основе гадолиния (магневист, омнискан, дотарем) и суперпарамагнитные соединения оксида железа в качестве пероральных контрастирующих средств (абдоскан, люмирем).
Диагностика травматических поражений с помощью МРТ - сложная и трудоёмкая задача. Часто из-за ряда причин (критическое состояние пациента, требующее использования реанимационного оборудования для поддержания жизненных функций, вынужденное положение, иммобилизующие шины и пр.) проведение МРТ становится невозможным. В острой стадии травмы МРТ имеет довольно ограниченное значение из-за относительной длительиосги исследования, а также в связи с низкой чувствительностью метода при диагностике острых гематом и повреждений костей.
Существенно повышается значение МРТ при обследовании пациентов в подострой и хронической стадиях травмы спинного мозга. Этому способствуют многопроекционность томографии с демонстрацией больших по протяжённости участков позвоночника и спинного мозга, возможность визуализации труднодоступных для других методов отделов позвоночника (краниовертебральная область, верхнегрудной отдел позвоночника). Сопутствующие травме позвоночника и спинного мозга отёк, очаги миеломаляции и некроза лучше определяются на Т2-взвешенных изображениях как области повышения интенсивности МР-сигнала (рис. 56).

Рис. 56. Компрессионный перелом тел позвонков Т7-Т11.
Особенно полезной следует считать МРТ при оценке состояния суставов, а также оценке последствий спинальной травмы. Без эндолюмбального использования контрастирующих препаратов при МРТ можно визуализировать состояние вещества спинного мозга, изменение его размеров и формы, атрофические изменения диффузного или локального характера, выявлять ликворные кисты и гидромиелитические полости.
К основным достоинствам метода относятся
- неинвазивность,
- отсутствие лучевой нагрузки (безвредность),
- 3-мерный характер получаемых изображений,
- естественный контраст от движущейся крови,
- отсутствие артефактов от костей,
- высокая дифференциация мягких тканей,
- возможность выполнения спектроскопии для прижизненного изучения метаболизма тканей in vitro.
Радионуклидные исследования
Наиболее значимые этапы радионуклидной диагностики скелета связаны применением в качестве метки её метаболических процессов нуклида 47Са (50-е годы прошлого века) и 85Ѕr (60-е годы прошлого века) как химического аналога кальция. Их основными недостатками являлся довольно длительный период полураспада (физическая величина, строго постоянная для каждого радионуклида, отражающая время, за которое произойдет распад половины имеющихся нестабильных атомов конкретного химического элемента, так, например, для 85Ѕr он ранен 64 дням) и относительно высокая энергия γ-излучения. Но при этом необходимо отметить и главное их достоинство - фармакокинетика указанных радионуклидов полностью отражала процессы метаболизма основного элемента минерального компонента костной ткани - кальция.
В 1971 г.в журнале «Nuclear medicine» было опубликовано первое сообщение о применении полифосфата, меченного метастабильным нуклидом 99mТс, в качестве нового остеотропного РФП. Главными достоинствами его являлись низкая энергия γ-излучения и короткий период полураспада (6,1 ч). Но при этом необходимо отметить, что практически всё последующее время идет дискуссия - что является главным акцептором данного РФП и какие именно процессы метаболизма им индицируются.
Тем не менее радионуклидная диагностика заболеваний и повреждений скелета сегодня входит в число методов, без которых трудно представить современную ортопедию и травматологию.
Суть радионуклидной диагностики скелета, как, впрочем, и любого другого органа и ткани, - радиометрия с помощью высокочувствительных радиометрических устройств. Совершенствование их детекторных блоков (сцинтилляционных датчиков), включение в комплексы мощной вычислительной техники уже привели к тому, что суммарная лучевая нагрузка, являющаяся главным поводом для ограничений в использовании источников ионизирующего излучения, стала не только сравнимой с таковой при традиционной рентгенографии, но и в ряде случаев даже меньше последней.
Главным приёмом в оценке результатов радионуклидной диагностики скелета является сравнение показателей накопления РФП в исследуемой поражённой области и в аналогичной интактной. Следует помнить, что сравнение значений фактически зарегистрированных γ-квантов осуществляется с учётом времени экспозиции и величины площади «зоны интереса». Среди основных вариантов различия указанных показателей к двум основным относятся повышенное и пониженное накопление РФП. Достоверным считается различие более 20%, но опытные специалисты при работе на высокочувствительной аппаратуре снижают этот порог и до 10%.
Необходимо отметить и ещё два встречающихся на практике варианта - ложноположительный и ложно-отрицательный. Поэтому результаты радионуклидной диагностики скелета должны стоять в ряду других сведений о больном как часть комплексной диагностики, приводящей в своей совокупности к правильному диагнозу и соответственно - к корректной лечебной тактике.
Суть радиодиагностической процедуры іn vivо крайне проста: в организм человека вводят РФП с последующей внешней радиометрией γ-квантов, выделяющихся при его физическом распаде. Абсолютно ясно, что эти γ-кванты выделяются с момента приготовления РФП.
Поскольку при проведении радиодиагностических процедур в ортопедии и травматологии самый популярный метод введения остеотропного РФП - внутривенный, то первый блок получаемой информации о состоянии опорно-двигательного аппарата будет отражать характеристику сосудистого русла в интересующей зоне, или области. Размеры этой области определяются только фактическими размерами сцинтилляционного кристалла натрия йодида в детекторе гамма-камеры.
Если радиометрия начинается за несколько секунд до введения препарата, а в этом нет никакой сложности, то врач получает возможность наблюдать весь процесс поведения РФП в сосудистом русле: от первичного прохождения в нём его болюса до равномерного распределения, которое наступает через несколько минут.
В результате математической обработки полученных данных в распоряжении врача оказывается график, на котором достаточно отчётливо можно видеть так называемые артериальную, венозную и смешанную фазы кровотока.
«Артериальная» фаза кровотока является результатом регистрации прохождения болюса РФП в артериях интересующей области после перехода его из вены в малый круг кровообращения и попадания в большой. Уже на этом пути происходит растворение РФП в крови, поэтому результаты радиометрии для оценки «артериальной» фазы будут зависеть от объёма, концентрации и скорости введения препарата - чем меньше его объём, выше первичная концентрация и меньше время введения, тем дальше по кровеносному руслу он будет сохранять характеристику болюса.
«Венозная» фаза кровотока может быть так названа достаточно условно, так как в результате перехода болюса РФП из артериальной сети в венозную он понесёт достаточно ощутимые потери в своей концентрации. Но, тем не менее, после «артериального» пика наблюдается снижение числа регистрируемых γ-квантов с быстрым их подъёмом вновь. Это значит, что РФП возвращается по венозной сети, что повышает концентрацию препарата в массиве интересующей области. Анализ такого повторного подъёма числа регистрируемых γ-квантов и позволяет дать характеристику состояния венозной сети.
«Смешанная» фаза наблюдается буквально через несколько минут от начала радиодиагностической процедуры. К этому моменту РФП равномерно распределяется в кровеносном русле и проводимая радиометрия отражает суммарную концентрацию препарата в артериальной, венозной и капиллярной сетях.
Следует отметить, что такая диагностика состояния сосудистого русла может проводиться и как первый этап в радионуклидном обследовании костного скелета с применением остеотропных РФП, и самостоятельно, но с использованием интактных для костей препаратов (например, пертехнетат).
К преимуществам радионуклидной диагностики состояния сосудистого русла в сравнении с рентгенологическими методами с контрастированием могут быть отнесены отсутствие противопоказаний, значительно меньшая лучевая нагрузка, отсутствие реакции сосудистой стенки, доступность для исследования практически любой области опорнодвигательного аппарата и некоторые другие. В частности, в качестве дополнительной врач может получить информацию о косвенных признаках функционального состояния почек, поскольку применяемые в ортопедии и травматологии РФП выводятся из организма именно через почки.
В сравнении с нелучевыми методами диагностики сосудистого русла (например, допплерография) данный метод также имеет определённые преимущества, важнейшим из которых является возможность визуализировать ограниченные области, или очаги, с избыточным и недостаточным кровообращением.
К недостаткам данного метода диагностики состояния кровеносного русла следует отнести отсутствие возможности детального изучения конкретных сосудов, определённую зависимость от качества выполнения радиодиагностической процедуры (исходная концентрация препарата, скорость его введения), повышенную лучевую нагрузку на критические органы, к которым относятся половые железы (из-за высокой концентрации γ-излучаюшего препарата в мочевом пузыре).
Сразу после попадания остеотропното РФП в кровеносное русло начинаются его миграция в костную ткань и выведение из организма. Не останавливаясь на детальном изложении этих процессов, можно отметить, что в радиобиологии указанные процессы подвергаются количественному анализу.
Имея в виду то, что в радионуклидной диагностике опорно-двигательного аппарата в последние десятилетия используется только короткоживущий метастабильный 99mТс, необходимо отметить, что он сам по себе не обладает остеотропностью. Остеотропность определяется его носителями, среди которых ведущими являются дифосфонаты, образующие с технецием комплексные соединения.
Именно эти соединения попадают из кровеносного русла в костную ткань, где и происходит их накопление. В первый час от начала радиодиагностической процедуры, когда ещё достаточна концентрация РФП в крови, радиометрия не позволяет достоверно дифференцировать процесс накопления препарата в скелете. Но по мере реализации двух уже упомянутых путей миграции РФП в организме - выведение из организма через почки и накопление в костях - создаются все условия для количественной оценки последнего. Поэтому на практике радиометрию скелета осуществляют в течение 4-го часа от начала диагностической процедуры. Исследование в более поздние сроки теряет смысл из-за короткого периода полураспада 99mТс.
В норме остеотропный препарат с радиоактивной меткой равномерно распределяется по всему костному скелету. У взрослых различия в количестве зарегистрированных γ-квантов незначительны для разных костей и зависят только от массы живой костной ткани в каждой конкретной области.
У детей, в отличие от взрослых, в костях имеются физиологические зоны повышенного накопления РФП. Это ростковые зоны, где бы они ни были - от метафизов длинных трубчатых костей до апофизов тел позвонков. При завершении процесса роста и закрытия ростковых зон данные физиологические области повышенной гиперфиксации РФП исчезают. Здесь можно отметить, что, по нашему опыту, количественная характеристика накопления РФП в ростковых зонах у детей не является прямым линейным отражением их ростовой активности. Так, например, наблюдалось асимметричное снижение накоплении РФП в ростковых зонах длинных трубчатых костей при длительной иммобилизации данной конечности. При этом каких-либо признаков. изменения её длины не отмечалосъ.
В результате заболевания или травмы естественным образом меняется функциональное состояние костной ткани. Вместе с ним меняется её способность акцентировать РФП. Высокочувствительная аппаратура, применяемая для выявления этого процесса, позволяет уверенно обнаруживать локальные изменения в нём и тем самым предоставляет врачу соответствующую информацию. На этом и построена идеология радионуклидной диагностики в ортопедии и травматологии.
Локальное нарушение в костной ткани может быть выявлено и другими методами лучевой диагностики. Но главное преимущество радионуклидного метода в том, что он информирует об отклонениях в её функциональном состоянии ещё до появления структуральных изменений, т.е. на дорентгенологическом этапе.
Таким образом, врач при проведении радионуклидной диагностики костного скелета определяет наличие и распространённость области в скелете с нарушенным функциональным состоянием костной ткани. К этому следует добавить, что современная аппаратура позволяет при однократном введении РФП исследовать абсолютно весь скелет, что очень выгодно при полифокальных заболеваниях.
С другой стороны, большой интерес у врача вызывает вопрос об активности патологического процесса, когда изменения структуры костной ткани налицо. Любая лучевая диагностика (рентгенография, КТ, МРТ и др.) будет отражать уже прошедшие события. Исключением из этого является радионуклидная диагностика, основанная на прижизненной индикации протекающих в данное время процессов.
Таким образом, обеспечивается второй информационный блок - сведения об активности патологического или восстановительного процесса. Именно поэтому данный метод диагностики остаётся без конкурентов при хронических вялотекущих заболеваниях. К ним относятся остеомиелиты, артриты и артрозы, замедленная консолидация и дистрофические локальные поражения костей и мн. др.
Здесь необходимо остановиться на том, о чём уже было упомянуто выше, - до настоящего времени идет дискуссия о главных «действующих лицах», участвующих в акцептировании 99mТс-дифосфоната. Без чёткого представления об этом довольно сложно представить себе суть патофизиологического процесса, характеристики распространённости и активности которого получатся без особых затруднений.
Объём главы не даёт возможностей для подробного изложения различных, порой диаметрально противоположных, точек зрения на вопрос о месте акцептирования 99mТс-дифосфоната.
Вперёд: http://healthy-back.livejournal.com/231878.html
Назад: http://healthy-back.livejournal.com/231254.html
К содержанию: http://healthy-back.livejournal.com/228626.html