Как это работает: в продолжение темы "Иммунная система и рак".
Не исключено, что первая ласточка триумфа иммунологического направления в онкологии таки вылупилась из яйца в этом году, на ASCO 2013. Если кратко, в статье идет речь о том, что комбинация двух новых препаратов вызвала выраженные, быстрые, а главное длительные ответы у большей части больных с метастатической меланомой, которые получили эту терапию.
Что здесь примечательного?
Во-первых то, что добиться эффекта у более 50-ти процентов больных с метастатической стадией этой опухоли вообще пока ни у кого не получалось. Во-вторых, если и получалось добиться подобных результатов (на некоторых современных таргетных препаратах), то ответы были не длительные, и кратковременный эффект быстро сменялся прогрессированием у большинства больных. Со всеми вытекающими. Ну а в третьих...
А в третьих, ни один из двух применяемых препаратов не является противоопухолевым, не воздействует на саму опухоль!
Оба препарата воздействуют на определенные механизмы в иммунной системе пациента, блокируя некоторые рецепторы на поверхности одного из типов иммунных клеток - Т-лимфоцитов.
И я сейчас расскажу, как это работает, но вначале позволю себе небольшое историческое отступление.
То, что иммунная система человека реагирует на развитие опухоли, и пытается как-то с этой опухолью бороться, было замечено еще давно.
Многие опухоли при их микроскопическом исследовании оказываются насыщенными клетками иммунной системы, пытающимися уничтожить клетки опухоли. Для некоторых опухолей отмечены феномены спонтанного регресса, обусловленные эффективностью такой борьбы.
Также показано, что при иммунодефицитных состояниях у человека частота развития некоторых опухолей значительно увеличивается - например, саркома Капоши у больных СПИДом встречается намного чаще, чем у здоровых людей.
Замечено, при трансплантации рецепиентам органов, сопровождающейся последующей индуцированной иммуносупрессией, опухолевые заболевания у них возникают чаще и протекают более агрессивно, чем у тех пациентов, у которых никакой иммуносупрессии не проводилось.
И есть еще много фактов, которые говорят медикам, что иммунная система в принципе имеет потенциал, чтобы бороться с опухолью, но что-то у нее не получается, чего-то ей не хватает, или наоборот, что-то ей мешает.
Соответственно, исследования в онкоиммунологии, направленные на то, чтобы понять, что не дает иммунной системе эффективно бороться с опухолью, а также ориентированные на то, чтобы активировать, усилить имеющийся слабый иммунный ответ велись с переменным успехом, победами и поражениями, на протяжении последних примерно тридцати лет.
Вот краткий перечень методов, которые исследовались в этом направлении:
Цитокинотерапия. Этот метод основан на применении сигнальных молекул, которыми клетки иммунной системы «общаются» между собой, передавая друг другу информацию. О том, что пора начинать боевые действия, либо наоборот успокоиться и прекратить войну.
В организме есть разные типы иммунных клеток, тесно взаимоействующих между собой при помощи сигнальных молекул - цитокинов. Одни из этих клеток разрушают незнакомые им объекты. Другие исследует эти объекты, выбирая то, что отличает их от своих клеток, и передавая эту информацию другим клеткам, обучая и направляя их в сторону формирования того или иного типа иммунного ответа. Друге есть клетки-убийцы, получив от атигенпрезентирующих клеток информацию о вторжении врага, они атакают его, непосредственно вступая в рукопашную, разрывая стенки клетки-врага своими белками-перфоринами, либо применяя редкие приемы кунфу - активируют во враге механзмы запрограммированной смерти через извстные им тайный сигнаы. Третие клетки при постпуплении информации о противнике превращаются в фабрики по производству специальны веществ - антител, атакующих противника. Четвертые, клетки-помощники, помогают убийцам или клеткам-строителям, направляя развитие иммунного ответа по пути прямой клеточной атаки, либо строительства фабрик. Все эти клетки получают информацию и передают ее посредством синтеза сигнальных молекул - цитокинов.
Молекул, с помощью которых клетки общаются между собой, довольно много, но в онкологии нашли применение лишь некоторые из них - интерфероны-альфа, интерлейкин-2, фактор некроза опухолей (TNF). Эти молекулы удалось синтезировать тогда, когда стали доступны технологии генной инженерии - в генетический аппарат специальных бактерий подсаживали гены человека, ответственные за синтез этих цитокинов, что позволяло получить цитокины в промышленных масштабах. Эти цитокины фасовались в ампулы и применялись при некоторых опухолевых заболеваниях. И применяются до сих пор. Но, увы, с переменным успехом. Лишь у части больных, довольно небольшой, удается добиться противоопухолевого ответа с применением цитокинов. Почему так - не вполне понятно, мы не настолько хорошо знаем все взаимодействия в иммунной системе, и взаимодействия между этой системой и растущей опухолью, чтобы ответить на этот вопрос. Но, в любом случае, до наступления эры таргетной (молекулярнонаправленнной) терапии, интерфероны являлись, например, единственным более-менее эффективным способом лечения метастатического рака почки, и по сей день применяются как единственный клинически доказанный метод адьюватной (дополнительной послеоперационной) терапии меланомы высокого риска.
Клеточная терапия. Поскольку иммунная система пытается бороться с опухолью посредством атаки этой опухоли Т-лимфоцитами, клетками-убийцами, инфильтрируя, пропитывая ими опухоль, были предприняты пытки усилить эту часть противоопухолевого ответа. Для этого из опухоли извлекались те клетки, которые ее атаковали, затем они инкубировались в средах с цитокинами, и вводились обратно в огранизм больного. Эта терапия получила название TIL-терапии (от tumor infiltrating lymphocyte): терапии лимфоцитами, инфильтрирующими опухоль. Эта терапия, так же как и другие виды иммунотерапии, иногда демонстрирует неплохие эффекты, но они слишком редкие, а сам метод слишком дорог и трудоемок, чтобы это лечение получило широкое распространение.
Другой вид клеточной терапии - LAK-терапия, противоопухолевое лечение лимфокинактивированными клетками-убийцами. Однажды было замечено, что инкубация лимфоидных клеток в культуре с интерлейкином-2 вызывает появление клонов клеток, обладающих гораздо более сильной цитотоксичностью (способностью убивать другие клетки), чем обычные лимфоциты. На этом был основан способ, при котором из крови пациента извлекались иммунные клетки, помещались в среду с интерлейкином-2, а потом, после активации, вводились обратно в кровоток больного. Метод не получил широкого признания все потому же - ответы были редки и непродолжительны, и хоть интересны с научной точки зрения, но с низкой повторяемостью результата, что не позволяло использовать этот метод в практической медицине.
Одна из разработок в области LAK-терапии есть тема моей диссертации - в ее ходе я пытался понять причины низкой эффективности терапии, используя в качестве модели ограниченные плевральной полостью опухоли - метастатические плевриты, а для создания клонов клеток - донорские клетки, предполагая устранить таким образом предполагаемый дефект собственных лимфоцитов пациента. Что-то получилось, но не все, но это как бы отдельная тема, не для поста.
Вакцинотерапия. Поскольку одной из гипотез была гипотеза о том, что иммунная система просто не умеет узнавать опухолевые клетки, которые не являются чужеродными, то одним из направлений онкоиммунологии был (и есть) метод, основанный на попытках обучить иммунную систему распознаванию этих клеток. Точнее, не метод, а методы. Ибо типов вакцин много. Некоторые вакцины создавались с использованием все тех же методов генной инженерии - в опухолевую клетку приживлялся ген, ответственный, например, за синтез цитокинов, привлекающих внимание клеток иммунной системы. В других случаях брались клетки, ответственные за распознавание чужеродных клеток, и усиленно «кормились» лизатом собственных опухолевых клеток, после чего возвращались обратно в организм. В третьем случае из опухолевых клеток извлекались определенные иммуногенные молекулы - антигены, и в том или ином виде представлялись клеткам иммунной системы. Это перспективное направление, и им до сих пор активно занимаются, и получают какие-то результаты, но пока это все еще экспериментальный метод все по той же причине - мы не можем добиться постоянного противоопухолевого ответа у большинства больных, и сам метод слишком сложен и недостаточно эффективен, чтобы внедрять его в широкую практику.
Моноклональные антитела. Метод основан, опять же, на возможности с помощью генной инженерии получать специальные молекулярные комплексы - антитела, к каким-то конкретным молекулам на поверхности клетки. В норме в организме человека огромное количество антител - выработка антительного ответа - это одна из разновидностей иммунной защиты нашего организма вообще. В ответ на внедрение в наш организм, к примеру, незнакомой бактерии, B-лимфоциты нашей иммунной системы способны создавать молекулярно-ориентированное оружие, антитело, способное связываться с какой-то ранее распознанной молекулой на поверхности бактериальной клетки. По принципу ключ-замок. После того, как антитело связалось с такой молекулой, запускаются различные сценарии, итогами которых становится уничтожение бактериальной клетки.
Одним из таких запускаемых сценариев, является сценарий активации системы комплемента. В плазме человека циркулируют специальные вещества - звенья системы комплемента. Они безопасны в неактивном состоянии, но когда образуется комплекс антиген-антитело, происходит активация этих звеньев, в результате которой формируется грозный мембранатакующий комплекс, разрушающий стенку бактерии в том месте, где произошло связывание антитела с его целью. Как в торпеде взрывается тротил при ее ударе борт атакованного корабля, так система комплемента взрывается на стенке бактерии, разрушая ее и приводя к ее затоплению и гибели.
Другой сценарий - это блокирующие антитела. Эти антитела не вызывают разрушения мембраны атакованной клетки, но блокируют на ее поверхности те или иные механизмы, служащие клетке для ее развития и размножения. Закрывают замки ее дверей на прочный замок, и в атакованную клетки не могут попасть нужные ей сигнальные вещества. Вот эти антитела нашли широкое применение в онкологии, ибо было синтезировано много антител к рецепторам ростовых факторов.
Многие опухоли характеризуются тем, что в большом количество размещают на своей поверхности рецепторы к естественным, присутствующим в организме, факторам роста. Связывание ростовых факторов с этими рецепторами на поверхности опухоли ассоциировано с тем, что опухоль активней растет и размножается, и наличие на поверхности клетки таких рецепторов в большом количестве обычно связано с плохим прогнозом.
Например, есть такой рецептор HER-2neu, присутствующий на многих опухолях, но наиболее часто встречающийся на клетках рака молочной железы. Это рецептор к эпидермальному фактору роста, и если он есть на опухоли молочной железы, то заведомо известно, что опухоль эта будет быстрее развиваться и хуже отвечать на лечение, чем те опухоли, где этот рецептор не экспрессируется.
К этому рецептору создано антитело, выпускаемое в настоящее время в виде лекарственного препарата трастузумаба, более известного как Герцептин. Герцептин блокирует рецепторы HER-2neu, не давая связываться им с факторами роста и истощая этим опухолевую клетку. Одновременно, в менее значительной степени он активирует механизмы антителзависимой клеточной цитотоксичности, помогая клеткам иммунной системы распознавать и уничтожать опухоль.
На сегодняшний день синтезировано уже много моноклональных антител к самым разным рецепторам, и эти антитела в виде коммерческих препаратов активно используются в онкологии. Многие из них на слуху - Мабтера, Авастин, тот же Герцептин, многие еще неизвестны широкой публике.
Вирусная терапия. Разумеется, предпринимались и предпринимаются попытки создать вирусы, способные избирательно атаковать опухоли. Задумка тут в том, что вирусы по природе своей обладают двумя важными свойствами - тропностью к определенным тканям и способностью встраивать в чужой генетический аппарат свои собственные гены. Вирусы способны убивать клетку, размножаться в ней, и единожды внедрившись, развивать вирусную инфекцию - в ходе которой вирусов становится все больше. То есть, по задумке, может получиться саморазмножающееся в организме лекарство.
Работы тут ведутся в двух направлениях - в направлении создания геномодицифированных вирусов, которые способны размножаться только в опухолевой клетке, убивая ее, но не трогая нормальные клетки, и в поисках вирусов, которые размножаясь в клетке, вызывают появление на ее поверхности вирусных белков, узнаваемых иммунной системой - то есть, вызывают появление в опухоли новые распознаваемые отличия от здоровых клеток. Последнее называется вирусной гетерогенизацией опухоли. Это очень интересное направление, и я с ним даже поработал когда-то, и даже успел заразиться одним из таких мутантов-вирусов, прям как в каком-нибудь фильме про драматическую медицину или зомби-апокалипсис. Но на практике распространения этого метода так и не произошло: возникли непреодолимые препятствия: с одной стороны, вирусы отказываются проникать во все опухолевые клетки, а это необходимо, ибо оставшиеся успешно разможатся; а во-вторых, иммунная система успевает вовремя среагировать и быстрее уничтожать инфицированные клетки вместе с вирусами. В общем, пока плохо получается, но теоретически это исправимо, и работы в этом направлении ведутся.
Ну и само собой разумеется, попутно исследовалось все иное что могло исследоваться - все иммуномодуляторы, интерфероногены, «стимуляторы иммунитета», чаги и прочие грибы, растения, гормоны вилочковой железы, и прочая «немолекулярно-неклеточная бня», которая по результатам этих исследований применяется в настоящее время лишь с двумя целями - дополнительного к лечению плацебо и для извлечения прибыли теми, кто ей торгует. В онкологии, по крайней мере.
Так же были исследованы всякие заражения паразитами, инфекциями, тут иногда кое-чего получали, и в некоторых местах работы в этом направлении даже ведутся, но что-либо более-менее серьезное относится в настоящее время только к применению бациллы Кальметта-Герена (ослабленная микобактерия туберкулеза, которой делают прививку БЦЖ) в терапии рака мочевого пузыря и попытках терапии меланомы.
Еще одна штука, которую стоит упомянуть - топический имиквимод. Мазь, которая вызывает в месте ее нанесения очень сильную воспалительную реакцию, вызывая миграцию в область опухоли клеток иммунной системы. Мазь неплохо работает при базальноклеточном раке и зарегистрирована для лечения его поверхностных форм, эффективна порой при транзиторных метастазах меланомы, и при первичной опухоли иногда тоже - есть и такие работы. Правда, случается, что в процессе лечения такой мазью само лечение хуже болезни - сейчас как раз наблюдаю картину гиперергической реакции на имиквимод у молодой пациентки с базальноклетоым раком, в ходе которого воспаление в области нанесения мази приобрело поистине страшный характер. Терапию пришлось прервать, теперь боремся с воспалением, вместо того, чтобы бороться с раком.
Ну а теперь вернемся к нашей новости. Что же из себя представляют упомянутые препараты?
Они представляют из себя блокирующие моноклональные антитела к двум рецепторам на поверхности лимфоцитов, клеток-убийц: CTLA-4 и PD-1. Связываясь с этими рецепторами на поверхности цитотоксических Т-лимфоцитов, они блокируют дальнейшее связывание этих рецепторов с тем, для чего они предназначены. И блокируя связывание, они блокируют функцию - то есть, не дают реализовываться тому сигналу, который через эти рецепторы передается. Это как повязка на глаза: вы ее надели и свет больше не поступает на сетчатку, ваша функция ориентации в пространстве нарушена, что в свою очередь вызовет нарушения целого ряда функций - вы не сможете идти, не ударяясь о предметы, не сможете уклониться от опасности, когда что-то полетит вам в голову.
Какова же конкретно функция этих рецепторов?
Начнем с CTLA-4. Это естественный блокер активности клетки-убийцы. Нужен этот сигнал для того, чтобы способность Т-лимфоцита убивать не была постоянной, а это, в свою очередь нужно, чтобы наубивавшись врагов, он не начал убивать собственные клетки.
Как это работает?
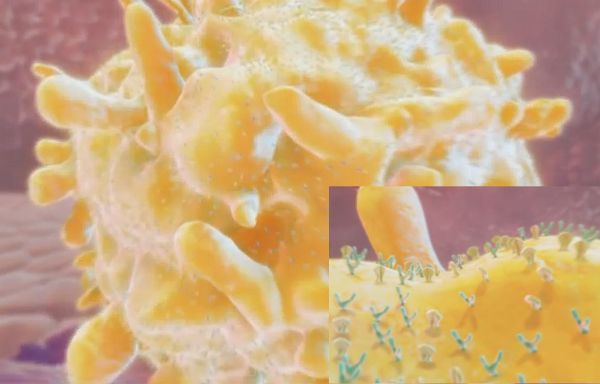
На картинке Т-лимфоцит. Если посмотреть на него поближе, то на его поверхности видно много-много мельчайших рецепторов. Эти рецепторы - его глаза, уши, все что угодно. Через эти рецепторы он получает приказы от клеток-командиров, узнает от них, кого надо убивать, и от них же получает команду прекратить атаку.
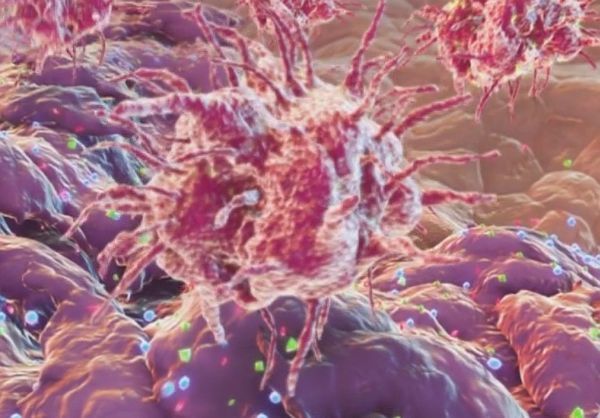
Командиром в определенном смысле для него служит дендритная клетка. На представленной картинке этот монстр собирает антигены опухолевых клеток. Собирает и анализирует. Для дальнейшей презентации этих антигенов лимфоцитам и для их активации. Это антигенпрезентирующая клетка.
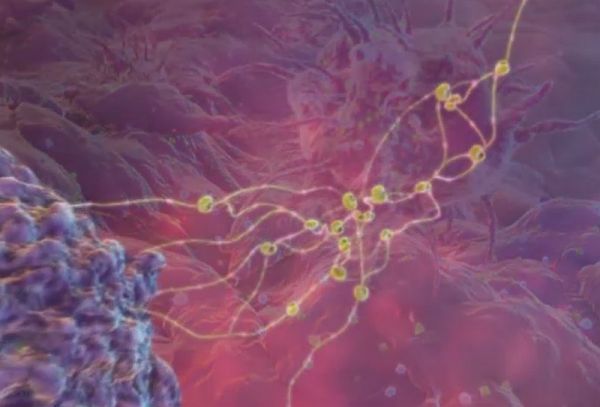
Собрав то, что ей надо для работы, дендритная клетка чинно удаляется в ближайший лимфатический узел.
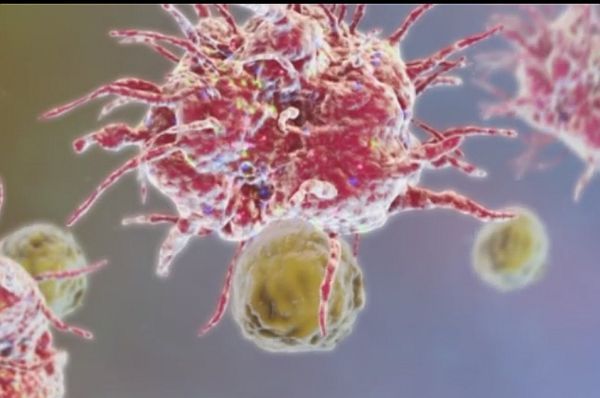
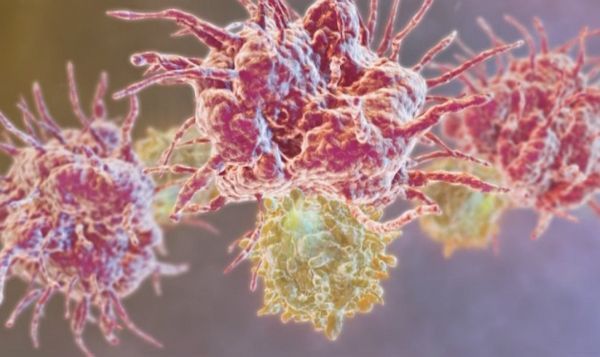
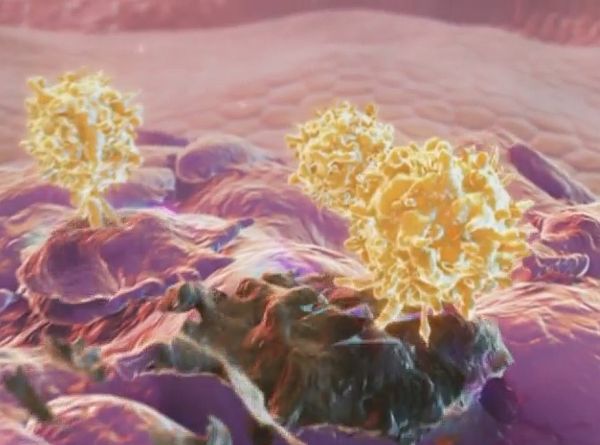
Где и происходит процесс активации лимфоцитов. Первый раз контактируя с лимфоцитом, дендритная клетка передает ему стимулирующий сигнал. Получив его, лимфоцит отращивает на себе такие вот отростки, предназначенные для убийства, начинает активно двигаться, делиться, а затем активированные лимфоциты покидают лимфатический узел и устремляются в атаку на врага. В данном случае на опухоль.
Но стимулирующий сигнал не только стимулирует активность лимфоцитов. Он стимулирует синтез в них тех самых естественных блокеров - рецепторов CTLA-4. Эти рецепторы активно синтезируются, пока лимфоцит выполняет свою функцию и насыщают собой его поверхность.
Когда контакт с дендритной клеткой происходит во второй раз, происходит связывание рецептора CTLA-4 со специальным корецептором на поверхности дендритной клетки, через который та дает ему команду остановиться. Лимфоцит убирает свои отростки и перестает атаковать клетки-мишени. Отправляется, так сказать, на заслуженный отдых. Опухоли от этого только плюс - ее много, и все ее клетки массированная, но непродолжительная атака Т-лимфоцитов убить не смогла. Оставшиеся начинают активно размножаться.

А вот если CTLA-4 на лимфоцитах заблокировать, то они не получат останавливающий сигнал. Пилот самолета не увидит красную ракету, сигнализирующую прекращение атаки, не услышит команду по рации, и будет продолжать бомбить цель. Бомбить и бомбить. Он превратится в берсерка, страшного в своем гневе и неостановимого. В какой-то момент он начнет путать свои и чужие города: лимфоциту может показаться, что клетки печени теперь враги, или клетки щитовидной железы, или собственные оболочки мозга, и он начнет разрушать их. Но и опухоль он тоже будет продолжать уничтожать.
Здесь нужен верховный главнокомандующий, который будет отслеживать этот процесс и остановит его в нужный момент, в попытке соблюсти баланс между противоопухолевым и аутоиммунным (направленным против себя самого) ответом - это есть лечащий врач, стратег, видящий процесс издалека и целиком :) Никакой, даже самой умной системе клеточной регуляции, тут не справиться.
Блокаторы CTLA-4 изучаются уже довольно давно. Недавно один из этих препаратов - ипилимумаб, был зарегистрирован FDA, и вышел в практическую медицину. Уже сотни пациентов получили им лечение. В тех случаях, когда препарат вызывает противоопухолевый ответ, он, этот ответ, характеризуется длительностью, что очень важно, поскольку все препараты для лечения метастатической меланомы до сей поры давали нам только кратковременные эффекты. Дальше опухоль приспосабливалась к препаратам и продолжала развиваться. Этот работает долго. Проблема заключается в том, что препарат вызывает ответ отнюдь не у всех больных. Почему - было не очень понятно, но была одна идея…
И вот в данной статье описано, что добавление к препарату другого блокирующего антитела, резко повысило количество пациентов, отвечающих на терапию. При этом, с еще более выраженным и продолжительным ответом, чем только на ипилимумабе.
Второе моноклональное антитело называется ниволумаб. Это антитело к рецептору PD-1, на поверхности все того же лимфоцита-убийцы. Это тоже естественный блокер активности лимфоцита, но есть в нем одна интересная особенность. Дело в том, что опухолевые клетки могут уклоняться от иммунного ответа синтезируя молекулы, которые связываются с эти естественным блокером. То есть, в случае с PD-1 не дендритная клетка останавливает берсерка, а сама опухоль. Это, по всей видимости, и есть тот самый непонятный ранее механизм того, что блокада CTLA-4 не дает надлежащего противоопухолевого ответа. Тут как бы получается, что своя клетка уже не блокирует этот ответ, после связывания препарата с CTLA-4, командир не дает команды, но такую команду дает враг: активность лифоцита блокирует сама опухоль, подобравшая ключ к другому замку в лимфоците. И вот ниволумаб блокирует именно этот путь - не дает самой опухоли дезактивировать Т-лимфоцит. Отсюда и сочетанная эффективность двух препаратов.
Почему не в ста процентов случаев? А есть еще замки, к которым человеком пока не подобраны ключи. И не все из них даже еще известны. Но будут подобраны. Рано или поздно. Ибо мы умные порой.
Ну а касательно этого нашего птенца, вылупившегося из яйца, будет ли он широко применяться в онкологии? Пока неизвестно. Нужны еще дополнительные клинические исследования, на большом количестве пациентов. Но есть все предпосылки к тому, что будет. Что однажды вылупившийся птенец скоро с тем же успехом вылетит из гнезда, завоевывая себе все новое пространство: ибо есть отдельные данные, что механизм этот, эффективный по первым данным для меланомы, эффективен и для других опухолей. Ибо опухоли разные, а иммунный ответ универсален. Будем жать и смотреть, и исследовать.
Примечания:
1. Этот пост не предназначен для того, чтобы вызывать надежду у кого-либо. Упомянутые методики лечения пока, увы, дело будущего. Как и доступность этих препаратов. Сейчас рано пытаться получить такое лечение, это очень тяжело и доступно иногда только в рамках клинических исследований . Увы, но по прежнему лучший метод борьбы с меланомой - ее ранняя диагностика.
2. Авторские права на большую часть картинок в посте принадлежат корпорации Пфайзер. При этом препараты ей не принадлежат, так что я не рекламирую таким образом эту корпорацию. Препараты вообще разных производителей. Но об авторском праве на картинки я должен упомянуть, и если у Пфайзер возникнут ко мне претензии по поводу размещения, я их уберу, конечно.
3. Традиционно я буду рад перепостам в ЖЖ, но категорически против использования и любого цитирования этого поста в любых СМИ.
4. Если кто-то осилил эту простыню до конца и она оказалась вам интересной - спасибо, вы героический читатель :)
Что здесь примечательного?
Во-первых то, что добиться эффекта у более 50-ти процентов больных с метастатической стадией этой опухоли вообще пока ни у кого не получалось. Во-вторых, если и получалось добиться подобных результатов (на некоторых современных таргетных препаратах), то ответы были не длительные, и кратковременный эффект быстро сменялся прогрессированием у большинства больных. Со всеми вытекающими. Ну а в третьих...
А в третьих, ни один из двух применяемых препаратов не является противоопухолевым, не воздействует на саму опухоль!
Оба препарата воздействуют на определенные механизмы в иммунной системе пациента, блокируя некоторые рецепторы на поверхности одного из типов иммунных клеток - Т-лимфоцитов.
И я сейчас расскажу, как это работает, но вначале позволю себе небольшое историческое отступление.
То, что иммунная система человека реагирует на развитие опухоли, и пытается как-то с этой опухолью бороться, было замечено еще давно.
Многие опухоли при их микроскопическом исследовании оказываются насыщенными клетками иммунной системы, пытающимися уничтожить клетки опухоли. Для некоторых опухолей отмечены феномены спонтанного регресса, обусловленные эффективностью такой борьбы.
Также показано, что при иммунодефицитных состояниях у человека частота развития некоторых опухолей значительно увеличивается - например, саркома Капоши у больных СПИДом встречается намного чаще, чем у здоровых людей.
Замечено, при трансплантации рецепиентам органов, сопровождающейся последующей индуцированной иммуносупрессией, опухолевые заболевания у них возникают чаще и протекают более агрессивно, чем у тех пациентов, у которых никакой иммуносупрессии не проводилось.
И есть еще много фактов, которые говорят медикам, что иммунная система в принципе имеет потенциал, чтобы бороться с опухолью, но что-то у нее не получается, чего-то ей не хватает, или наоборот, что-то ей мешает.
Соответственно, исследования в онкоиммунологии, направленные на то, чтобы понять, что не дает иммунной системе эффективно бороться с опухолью, а также ориентированные на то, чтобы активировать, усилить имеющийся слабый иммунный ответ велись с переменным успехом, победами и поражениями, на протяжении последних примерно тридцати лет.
Вот краткий перечень методов, которые исследовались в этом направлении:
Цитокинотерапия. Этот метод основан на применении сигнальных молекул, которыми клетки иммунной системы «общаются» между собой, передавая друг другу информацию. О том, что пора начинать боевые действия, либо наоборот успокоиться и прекратить войну.
В организме есть разные типы иммунных клеток, тесно взаимоействующих между собой при помощи сигнальных молекул - цитокинов. Одни из этих клеток разрушают незнакомые им объекты. Другие исследует эти объекты, выбирая то, что отличает их от своих клеток, и передавая эту информацию другим клеткам, обучая и направляя их в сторону формирования того или иного типа иммунного ответа. Друге есть клетки-убийцы, получив от атигенпрезентирующих клеток информацию о вторжении врага, они атакают его, непосредственно вступая в рукопашную, разрывая стенки клетки-врага своими белками-перфоринами, либо применяя редкие приемы кунфу - активируют во враге механзмы запрограммированной смерти через извстные им тайный сигнаы. Третие клетки при постпуплении информации о противнике превращаются в фабрики по производству специальны веществ - антител, атакующих противника. Четвертые, клетки-помощники, помогают убийцам или клеткам-строителям, направляя развитие иммунного ответа по пути прямой клеточной атаки, либо строительства фабрик. Все эти клетки получают информацию и передают ее посредством синтеза сигнальных молекул - цитокинов.
Молекул, с помощью которых клетки общаются между собой, довольно много, но в онкологии нашли применение лишь некоторые из них - интерфероны-альфа, интерлейкин-2, фактор некроза опухолей (TNF). Эти молекулы удалось синтезировать тогда, когда стали доступны технологии генной инженерии - в генетический аппарат специальных бактерий подсаживали гены человека, ответственные за синтез этих цитокинов, что позволяло получить цитокины в промышленных масштабах. Эти цитокины фасовались в ампулы и применялись при некоторых опухолевых заболеваниях. И применяются до сих пор. Но, увы, с переменным успехом. Лишь у части больных, довольно небольшой, удается добиться противоопухолевого ответа с применением цитокинов. Почему так - не вполне понятно, мы не настолько хорошо знаем все взаимодействия в иммунной системе, и взаимодействия между этой системой и растущей опухолью, чтобы ответить на этот вопрос. Но, в любом случае, до наступления эры таргетной (молекулярнонаправленнной) терапии, интерфероны являлись, например, единственным более-менее эффективным способом лечения метастатического рака почки, и по сей день применяются как единственный клинически доказанный метод адьюватной (дополнительной послеоперационной) терапии меланомы высокого риска.
Клеточная терапия. Поскольку иммунная система пытается бороться с опухолью посредством атаки этой опухоли Т-лимфоцитами, клетками-убийцами, инфильтрируя, пропитывая ими опухоль, были предприняты пытки усилить эту часть противоопухолевого ответа. Для этого из опухоли извлекались те клетки, которые ее атаковали, затем они инкубировались в средах с цитокинами, и вводились обратно в огранизм больного. Эта терапия получила название TIL-терапии (от tumor infiltrating lymphocyte): терапии лимфоцитами, инфильтрирующими опухоль. Эта терапия, так же как и другие виды иммунотерапии, иногда демонстрирует неплохие эффекты, но они слишком редкие, а сам метод слишком дорог и трудоемок, чтобы это лечение получило широкое распространение.
Другой вид клеточной терапии - LAK-терапия, противоопухолевое лечение лимфокинактивированными клетками-убийцами. Однажды было замечено, что инкубация лимфоидных клеток в культуре с интерлейкином-2 вызывает появление клонов клеток, обладающих гораздо более сильной цитотоксичностью (способностью убивать другие клетки), чем обычные лимфоциты. На этом был основан способ, при котором из крови пациента извлекались иммунные клетки, помещались в среду с интерлейкином-2, а потом, после активации, вводились обратно в кровоток больного. Метод не получил широкого признания все потому же - ответы были редки и непродолжительны, и хоть интересны с научной точки зрения, но с низкой повторяемостью результата, что не позволяло использовать этот метод в практической медицине.
Одна из разработок в области LAK-терапии есть тема моей диссертации - в ее ходе я пытался понять причины низкой эффективности терапии, используя в качестве модели ограниченные плевральной полостью опухоли - метастатические плевриты, а для создания клонов клеток - донорские клетки, предполагая устранить таким образом предполагаемый дефект собственных лимфоцитов пациента. Что-то получилось, но не все, но это как бы отдельная тема, не для поста.
Вакцинотерапия. Поскольку одной из гипотез была гипотеза о том, что иммунная система просто не умеет узнавать опухолевые клетки, которые не являются чужеродными, то одним из направлений онкоиммунологии был (и есть) метод, основанный на попытках обучить иммунную систему распознаванию этих клеток. Точнее, не метод, а методы. Ибо типов вакцин много. Некоторые вакцины создавались с использованием все тех же методов генной инженерии - в опухолевую клетку приживлялся ген, ответственный, например, за синтез цитокинов, привлекающих внимание клеток иммунной системы. В других случаях брались клетки, ответственные за распознавание чужеродных клеток, и усиленно «кормились» лизатом собственных опухолевых клеток, после чего возвращались обратно в организм. В третьем случае из опухолевых клеток извлекались определенные иммуногенные молекулы - антигены, и в том или ином виде представлялись клеткам иммунной системы. Это перспективное направление, и им до сих пор активно занимаются, и получают какие-то результаты, но пока это все еще экспериментальный метод все по той же причине - мы не можем добиться постоянного противоопухолевого ответа у большинства больных, и сам метод слишком сложен и недостаточно эффективен, чтобы внедрять его в широкую практику.
Моноклональные антитела. Метод основан, опять же, на возможности с помощью генной инженерии получать специальные молекулярные комплексы - антитела, к каким-то конкретным молекулам на поверхности клетки. В норме в организме человека огромное количество антител - выработка антительного ответа - это одна из разновидностей иммунной защиты нашего организма вообще. В ответ на внедрение в наш организм, к примеру, незнакомой бактерии, B-лимфоциты нашей иммунной системы способны создавать молекулярно-ориентированное оружие, антитело, способное связываться с какой-то ранее распознанной молекулой на поверхности бактериальной клетки. По принципу ключ-замок. После того, как антитело связалось с такой молекулой, запускаются различные сценарии, итогами которых становится уничтожение бактериальной клетки.
Одним из таких запускаемых сценариев, является сценарий активации системы комплемента. В плазме человека циркулируют специальные вещества - звенья системы комплемента. Они безопасны в неактивном состоянии, но когда образуется комплекс антиген-антитело, происходит активация этих звеньев, в результате которой формируется грозный мембранатакующий комплекс, разрушающий стенку бактерии в том месте, где произошло связывание антитела с его целью. Как в торпеде взрывается тротил при ее ударе борт атакованного корабля, так система комплемента взрывается на стенке бактерии, разрушая ее и приводя к ее затоплению и гибели.
Другой сценарий - это блокирующие антитела. Эти антитела не вызывают разрушения мембраны атакованной клетки, но блокируют на ее поверхности те или иные механизмы, служащие клетке для ее развития и размножения. Закрывают замки ее дверей на прочный замок, и в атакованную клетки не могут попасть нужные ей сигнальные вещества. Вот эти антитела нашли широкое применение в онкологии, ибо было синтезировано много антител к рецепторам ростовых факторов.
Многие опухоли характеризуются тем, что в большом количество размещают на своей поверхности рецепторы к естественным, присутствующим в организме, факторам роста. Связывание ростовых факторов с этими рецепторами на поверхности опухоли ассоциировано с тем, что опухоль активней растет и размножается, и наличие на поверхности клетки таких рецепторов в большом количестве обычно связано с плохим прогнозом.
Например, есть такой рецептор HER-2neu, присутствующий на многих опухолях, но наиболее часто встречающийся на клетках рака молочной железы. Это рецептор к эпидермальному фактору роста, и если он есть на опухоли молочной железы, то заведомо известно, что опухоль эта будет быстрее развиваться и хуже отвечать на лечение, чем те опухоли, где этот рецептор не экспрессируется.
К этому рецептору создано антитело, выпускаемое в настоящее время в виде лекарственного препарата трастузумаба, более известного как Герцептин. Герцептин блокирует рецепторы HER-2neu, не давая связываться им с факторами роста и истощая этим опухолевую клетку. Одновременно, в менее значительной степени он активирует механизмы антителзависимой клеточной цитотоксичности, помогая клеткам иммунной системы распознавать и уничтожать опухоль.
На сегодняшний день синтезировано уже много моноклональных антител к самым разным рецепторам, и эти антитела в виде коммерческих препаратов активно используются в онкологии. Многие из них на слуху - Мабтера, Авастин, тот же Герцептин, многие еще неизвестны широкой публике.
Вирусная терапия. Разумеется, предпринимались и предпринимаются попытки создать вирусы, способные избирательно атаковать опухоли. Задумка тут в том, что вирусы по природе своей обладают двумя важными свойствами - тропностью к определенным тканям и способностью встраивать в чужой генетический аппарат свои собственные гены. Вирусы способны убивать клетку, размножаться в ней, и единожды внедрившись, развивать вирусную инфекцию - в ходе которой вирусов становится все больше. То есть, по задумке, может получиться саморазмножающееся в организме лекарство.
Работы тут ведутся в двух направлениях - в направлении создания геномодицифированных вирусов, которые способны размножаться только в опухолевой клетке, убивая ее, но не трогая нормальные клетки, и в поисках вирусов, которые размножаясь в клетке, вызывают появление на ее поверхности вирусных белков, узнаваемых иммунной системой - то есть, вызывают появление в опухоли новые распознаваемые отличия от здоровых клеток. Последнее называется вирусной гетерогенизацией опухоли. Это очень интересное направление, и я с ним даже поработал когда-то, и даже успел заразиться одним из таких мутантов-вирусов, прям как в каком-нибудь фильме про драматическую медицину или зомби-апокалипсис. Но на практике распространения этого метода так и не произошло: возникли непреодолимые препятствия: с одной стороны, вирусы отказываются проникать во все опухолевые клетки, а это необходимо, ибо оставшиеся успешно разможатся; а во-вторых, иммунная система успевает вовремя среагировать и быстрее уничтожать инфицированные клетки вместе с вирусами. В общем, пока плохо получается, но теоретически это исправимо, и работы в этом направлении ведутся.
Ну и само собой разумеется, попутно исследовалось все иное что могло исследоваться - все иммуномодуляторы, интерфероногены, «стимуляторы иммунитета», чаги и прочие грибы, растения, гормоны вилочковой железы, и прочая «немолекулярно-неклеточная бня», которая по результатам этих исследований применяется в настоящее время лишь с двумя целями - дополнительного к лечению плацебо и для извлечения прибыли теми, кто ей торгует. В онкологии, по крайней мере.
Так же были исследованы всякие заражения паразитами, инфекциями, тут иногда кое-чего получали, и в некоторых местах работы в этом направлении даже ведутся, но что-либо более-менее серьезное относится в настоящее время только к применению бациллы Кальметта-Герена (ослабленная микобактерия туберкулеза, которой делают прививку БЦЖ) в терапии рака мочевого пузыря и попытках терапии меланомы.
Еще одна штука, которую стоит упомянуть - топический имиквимод. Мазь, которая вызывает в месте ее нанесения очень сильную воспалительную реакцию, вызывая миграцию в область опухоли клеток иммунной системы. Мазь неплохо работает при базальноклеточном раке и зарегистрирована для лечения его поверхностных форм, эффективна порой при транзиторных метастазах меланомы, и при первичной опухоли иногда тоже - есть и такие работы. Правда, случается, что в процессе лечения такой мазью само лечение хуже болезни - сейчас как раз наблюдаю картину гиперергической реакции на имиквимод у молодой пациентки с базальноклетоым раком, в ходе которого воспаление в области нанесения мази приобрело поистине страшный характер. Терапию пришлось прервать, теперь боремся с воспалением, вместо того, чтобы бороться с раком.
Ну а теперь вернемся к нашей новости. Что же из себя представляют упомянутые препараты?
Они представляют из себя блокирующие моноклональные антитела к двум рецепторам на поверхности лимфоцитов, клеток-убийц: CTLA-4 и PD-1. Связываясь с этими рецепторами на поверхности цитотоксических Т-лимфоцитов, они блокируют дальнейшее связывание этих рецепторов с тем, для чего они предназначены. И блокируя связывание, они блокируют функцию - то есть, не дают реализовываться тому сигналу, который через эти рецепторы передается. Это как повязка на глаза: вы ее надели и свет больше не поступает на сетчатку, ваша функция ориентации в пространстве нарушена, что в свою очередь вызовет нарушения целого ряда функций - вы не сможете идти, не ударяясь о предметы, не сможете уклониться от опасности, когда что-то полетит вам в голову.
Какова же конкретно функция этих рецепторов?
Начнем с CTLA-4. Это естественный блокер активности клетки-убийцы. Нужен этот сигнал для того, чтобы способность Т-лимфоцита убивать не была постоянной, а это, в свою очередь нужно, чтобы наубивавшись врагов, он не начал убивать собственные клетки.
Как это работает?

На картинке Т-лимфоцит. Если посмотреть на него поближе, то на его поверхности видно много-много мельчайших рецепторов. Эти рецепторы - его глаза, уши, все что угодно. Через эти рецепторы он получает приказы от клеток-командиров, узнает от них, кого надо убивать, и от них же получает команду прекратить атаку.

Командиром в определенном смысле для него служит дендритная клетка. На представленной картинке этот монстр собирает антигены опухолевых клеток. Собирает и анализирует. Для дальнейшей презентации этих антигенов лимфоцитам и для их активации. Это антигенпрезентирующая клетка.

Собрав то, что ей надо для работы, дендритная клетка чинно удаляется в ближайший лимфатический узел.


Где и происходит процесс активации лимфоцитов. Первый раз контактируя с лимфоцитом, дендритная клетка передает ему стимулирующий сигнал. Получив его, лимфоцит отращивает на себе такие вот отростки, предназначенные для убийства, начинает активно двигаться, делиться, а затем активированные лимфоциты покидают лимфатический узел и устремляются в атаку на врага. В данном случае на опухоль.
Но стимулирующий сигнал не только стимулирует активность лимфоцитов. Он стимулирует синтез в них тех самых естественных блокеров - рецепторов CTLA-4. Эти рецепторы активно синтезируются, пока лимфоцит выполняет свою функцию и насыщают собой его поверхность.
Когда контакт с дендритной клеткой происходит во второй раз, происходит связывание рецептора CTLA-4 со специальным корецептором на поверхности дендритной клетки, через который та дает ему команду остановиться. Лимфоцит убирает свои отростки и перестает атаковать клетки-мишени. Отправляется, так сказать, на заслуженный отдых. Опухоли от этого только плюс - ее много, и все ее клетки массированная, но непродолжительная атака Т-лимфоцитов убить не смогла. Оставшиеся начинают активно размножаться.

А вот если CTLA-4 на лимфоцитах заблокировать, то они не получат останавливающий сигнал. Пилот самолета не увидит красную ракету, сигнализирующую прекращение атаки, не услышит команду по рации, и будет продолжать бомбить цель. Бомбить и бомбить. Он превратится в берсерка, страшного в своем гневе и неостановимого. В какой-то момент он начнет путать свои и чужие города: лимфоциту может показаться, что клетки печени теперь враги, или клетки щитовидной железы, или собственные оболочки мозга, и он начнет разрушать их. Но и опухоль он тоже будет продолжать уничтожать.

Здесь нужен верховный главнокомандующий, который будет отслеживать этот процесс и остановит его в нужный момент, в попытке соблюсти баланс между противоопухолевым и аутоиммунным (направленным против себя самого) ответом - это есть лечащий врач, стратег, видящий процесс издалека и целиком :) Никакой, даже самой умной системе клеточной регуляции, тут не справиться.
Блокаторы CTLA-4 изучаются уже довольно давно. Недавно один из этих препаратов - ипилимумаб, был зарегистрирован FDA, и вышел в практическую медицину. Уже сотни пациентов получили им лечение. В тех случаях, когда препарат вызывает противоопухолевый ответ, он, этот ответ, характеризуется длительностью, что очень важно, поскольку все препараты для лечения метастатической меланомы до сей поры давали нам только кратковременные эффекты. Дальше опухоль приспосабливалась к препаратам и продолжала развиваться. Этот работает долго. Проблема заключается в том, что препарат вызывает ответ отнюдь не у всех больных. Почему - было не очень понятно, но была одна идея…
И вот в данной статье описано, что добавление к препарату другого блокирующего антитела, резко повысило количество пациентов, отвечающих на терапию. При этом, с еще более выраженным и продолжительным ответом, чем только на ипилимумабе.
Второе моноклональное антитело называется ниволумаб. Это антитело к рецептору PD-1, на поверхности все того же лимфоцита-убийцы. Это тоже естественный блокер активности лимфоцита, но есть в нем одна интересная особенность. Дело в том, что опухолевые клетки могут уклоняться от иммунного ответа синтезируя молекулы, которые связываются с эти естественным блокером. То есть, в случае с PD-1 не дендритная клетка останавливает берсерка, а сама опухоль. Это, по всей видимости, и есть тот самый непонятный ранее механизм того, что блокада CTLA-4 не дает надлежащего противоопухолевого ответа. Тут как бы получается, что своя клетка уже не блокирует этот ответ, после связывания препарата с CTLA-4, командир не дает команды, но такую команду дает враг: активность лифоцита блокирует сама опухоль, подобравшая ключ к другому замку в лимфоците. И вот ниволумаб блокирует именно этот путь - не дает самой опухоли дезактивировать Т-лимфоцит. Отсюда и сочетанная эффективность двух препаратов.
Почему не в ста процентов случаев? А есть еще замки, к которым человеком пока не подобраны ключи. И не все из них даже еще известны. Но будут подобраны. Рано или поздно. Ибо мы умные порой.
Ну а касательно этого нашего птенца, вылупившегося из яйца, будет ли он широко применяться в онкологии? Пока неизвестно. Нужны еще дополнительные клинические исследования, на большом количестве пациентов. Но есть все предпосылки к тому, что будет. Что однажды вылупившийся птенец скоро с тем же успехом вылетит из гнезда, завоевывая себе все новое пространство: ибо есть отдельные данные, что механизм этот, эффективный по первым данным для меланомы, эффективен и для других опухолей. Ибо опухоли разные, а иммунный ответ универсален. Будем жать и смотреть, и исследовать.
Примечания:
1. Этот пост не предназначен для того, чтобы вызывать надежду у кого-либо. Упомянутые методики лечения пока, увы, дело будущего. Как и доступность этих препаратов. Сейчас рано пытаться получить такое лечение, это очень тяжело и доступно иногда только в рамках клинических исследований . Увы, но по прежнему лучший метод борьбы с меланомой - ее ранняя диагностика.
2. Авторские права на большую часть картинок в посте принадлежат корпорации Пфайзер. При этом препараты ей не принадлежат, так что я не рекламирую таким образом эту корпорацию. Препараты вообще разных производителей. Но об авторском праве на картинки я должен упомянуть, и если у Пфайзер возникнут ко мне претензии по поводу размещения, я их уберу, конечно.
3. Традиционно я буду рад перепостам в ЖЖ, но категорически против использования и любого цитирования этого поста в любых СМИ.
4. Если кто-то осилил эту простыню до конца и она оказалась вам интересной - спасибо, вы героический читатель :)