Мелатонин: ингибитор ферроптоза с потенциальной терапевтической эффект-тью в борьбе с ускоренным Ч.3
старением мозга и нейродегенерацией после C0 19
Мелатонин и старение, нейродегенеративные заболевания и вирусы
Неоднократно утверждалось, что старение является вторичным явлением нарушения функции шишковидной железы, сопровождающееся очевидной потерей дневного и ночного ритма мелатонина и снижением его выработки в ночное время [ 233 , 234 , 235 , 236 ]. Мелатонин обладает антивозрастными свойствами и, как широко известно, борется с возрастными расстройствами как на экспериментальном, так и на клиническом уровне. Двадцатидвухмесячные крысы, которых кормили мелатонином в течение десяти недель, показали улучшение структуры костей и уменьшение возрастной потери костной массы [ 237 ]. Интересное исследование показало увеличение продолжительности жизни на 42% у старых мышей при трансплантации шишковидной железы от молодых и сокращение продолжительности жизни на 29% при трансплантации шишковидной железы от старых к молодым [ 238 ]. Кроме того, мелатонин улучшил иммунные функции у пожилых мышей с ослабленным иммунитетом [ 239 ]. В модели старения, вызванной d-галактозой, мелатонин усиливал связанные с этим дефекты пространственной памяти и восстанавливал пролиферацию нейронов [ 240 ]. У мышей, склонных к ускоренному старению (SAMP8), мелатонин продемонстрировал улучшение нейрогенеза в гиппокампе [ 241 ]. Мелатонин способствует замедлению старения благодаря своим противовоспалительным свойствам, подавляя процесс воспаления [ 242 ]. В дополнение к множеству полезных качеств мелатонин показал антиоксидантный эффект в гиппокампе старых крыс [ 243 ]. В рандомизированном контролируемом исследовании мелатонин улучшил качество сна и утреннюю активность у пожилых пациентов с первичной бессонницей [ 244 ]. Мелатонин улучшил послеоперационное снижение когнитивных функций, утомляемость и общее самочувствие у пожилых пациентов с эндопротезированием тазобедренного сустава [ 245 ]. Ретроспективное исследование с участием пациентов с легкими когнитивными нарушениями ( n = 25), принимавших мелатонин (3-9 мг) в течение 9-18 месяцев, показало лучшие результаты по Минимуму экзамену психического состояния (MMSE), когнитивной подшкале шкалы оценки болезни Альцгеймера. и множественные нейропсихологические тесты [ 246 ].
Многочисленные исследования нейродегенеративных расстройств, которые называют возрастными расстройствами, показали положительный результат при использовании мелатонина. Мелатонин неоднократно демонстрировал улучшение когнитивных нарушений, производительности памяти и связанной с ними тревоги и депрессии в различных моделях AD на мышах [ 247 , 248 , 249 ]. Мелатонин продемонстрировал тот же положительный имидж в экспериментальных моделях БП, улучшая нейроповеденческие задачи и устраняя нервный дефицит цитопротекторным образом [ 250 , 251 , 252 ]. Кроме того, в экспериментальных моделях мелатонин уменьшал тяжесть рассеянного склероза (РС) [ 253 ] и увеличивал время выживания при боковом амиотрофическом склерозе (БАС) [ 254 ]. К счастью, эти результаты в некоторой степени отражены в клинических исследованиях. Метаанализ 50 рандомизированных контролируемых исследований у пациентов с АД показал лучший результат по MMSE (среднесрочная низкая доза мелатонина связана с самым высоким MMSE после лечения (средняя разница = 1,48, 95% ДИ 0,51-2,46) ), оценивая когнитивные функции, с использованием низких доз мелатонина в среднесрочной перспективе [ 255 ]. Низкие уровни мелатонина были связаны со снижением когнитивных функций [ 256 ], а минимальные, но не дневные уровни мелатонина были связаны с когнитивной дисфункцией, согласно измерениям. MMSE у пациентов с легкими когнитивными нарушениями или деменцией Альцгеймера [ 258 ] Obayashi et al. сообщили, что более высокие концентрации метаболита мелатонина (6-сульфатоксимелатонин в моче: UME) связаны со значительно более низкими когнитивными показателями в MMSE ( n = 935) и в MMSE. Гериатрическая шкала депрессии ( n = 1097) [ 259 ] В рандомизированном контролируемом клиническом исследовании у 60 пациентов с болезнью Паркинсона 12 недель приема мелатонина (10 мг/день) улучшали когнитивные функции, тревожность и депрессию по сравнению с пациентами, принимавшими плацебо [ 260 ]. Пилотное исследование четырнадцати пациентов с рассеянным склерозом, принимавших 6 мг мелатонина перед сном, показало улучшение физических и когнитивных задач, включая постурографические тесты, монреальскую когнитивную оценку и простой тест на время реакции. Они также сообщили о лучшем качестве сна по опроснику сна Шпигеля [ 261 ]. Ретроспективный анализ базы данных клинических испытаний открытого доступа с объединенными ресурсами (PRO-ACT) продемонстрировал снижение уровня смертности среди пользователей мелатонина по сравнению с теми, кто не употреблял его, среди пациентов с БАС (95% ДИ 0,088-0,659, P = 0,0056). Интересно, что у потребителей мелатонина также наблюдалось более медленное снижение показателей по пересмотренной функциональной шкале бокового амиотрофического склероза (ALSFRS-R) (t = 2,71, P = 0,0069), которая оценивает физические функции пациентов и повседневную активность.262 ].
Мелатонин, широко вовлеченный в старение и нейродегенеративные расстройства, имеет свою собственную значимость и при вирусных инфекциях, демонстрируя свою великолепную универсальность. Комплексное противовоспалительное, антиоксидантное, антиапоптотическое и иммуномодулирующее действие мелатонина позволяет ему легко действовать как эффективное противовирусное средство [ 263 ]. Мелатонин пришел на помощь во время предыдущих вирусных вспышек, таких как инфекция венесуэльского лошадиного энцефаломиелита (VEE) в 1995 году [ 264 ], энцефалита Западного Нила в 2002 году [ 265 ], тяжелого острого респираторного синдрома (SARS) в 2003 году [ 266 ] и вирус Эбола в 2013 году [ 267 ]. Основные противовирусные действия мелатонина заключаются в том, что он снижает виремию, вирусную нагрузку в головном мозге, энцефалит, острое повреждение легких и уровень смертности [ 263 ].
Использование мелатонина при COVID-19
Во время пандемии COVID-19 внимание снова обратилось к мелатонину и его терапевтическому потенциалу, особенно с учетом его недостаточного уровня у пациентов с SARS-CoV-2. Йилмаз и Онер обнаружили более низкие уровни мелатонина в плазме у пациентов с пневмонией с положительным результатом на COVID-19 по сравнению со здоровыми людьми из контрольной группы в 23:00 и по сравнению с группой с пневмонией, отрицательной на COVID-19, и здоровыми людьми из контрольной группы в 02:00 и 06:00. Интересно, что они сообщили об отрицательной корреляции между уровнем мелатонина в плазме и показателями шкалы депрессии Бека (BDI), шкалы тревоги смерти Темплера (TDAS) и индекса тяжести бессонницы (ISI) у пациентов с SARS-CoV-2 [ 268] . ]. Их результаты предполагают потенциальную роль дефицита мелатонина в депрессии, тревоге и бессоннице, связанных с COVID-19, что стимулирует дальнейшие исследования по использованию мелатонина у пациентов с COVID-19 с такими осложнениями. Дефицит мелатонина при COVID-19 может возникнуть из-за неправильного усвоения пищевого триптофана, поскольку SARS-CoV-2 подавляет ангиотензинпревращающий фермент-2, шаперон транспортера триптофана [ 269 ]. Было предпринято несколько попыток изучить влияние мелаотонина на течение инфекции COVID-19. В исследовании 44 случаев COVID-19 Farnoosh et al. сообщили об уменьшении поражения легких, утомляемости, уровня СРБ, времени до выписки и более быстром возвращении к исходному состоянию здоровья у пациентов, получавших мелатонин в дозе 3 мг три раза в день в течение 14 дней [ 270 ]. Другое пилотное исследование, проведенное Fogleman et al. достигли аналогичного результата у пациентов с легкими и умеренными симптомами COVID-19, получавших мелатонин в дозе 10 мг/сут в течение 14 дней, продемонстрировав более быстрое разрешение симптомов [ 271 ]. В более крупном рандомизированном контролируемом исследовании с участием 118 пациентов с тяжелым течением COVID-19, госпитализированных в отделения интенсивной терапии, применялось 5 мг мелатонина два раза в день в течение 7 дней. Интересно, что они показали значительное улучшение уровня смертности, потребности в инвазивной искусственной вентиляции легких, продолжительности пребывания в больнице и отделении интенсивной терапии, а также продолжительность до клинического улучшения в группе мелатонина. Кроме того, они обнаружили значительное улучшение показателей СРБ, скорости оседания эритроцитов (СОЭ), уровня прокальцитонина, D-димера и сывороточного ферритина во время лечения мелатонином [ 272 ]. Помимо улучшения течения заболевания в больнице, мелатонин снизил частоту некоторых безжалостных осложнений COVID-19. Хасан и др. отслеживали возникновение сепсиса и тромбозов среди 158 пациентов с тяжелым течением COVID-19, из которых 82 получали мелатонин в дозе 10 мг/сут в течение 14 дней наряду со стандартной терапией. У пациентов, принимавших мелатонин, реже развивались тромбозы и сепсис, а уровень смертности был ниже [ 273] .]. Тем не менее, в некоторых отчетах отрицается потенциал мелатонина для улучшения течения и исхода COVID-19. В пилотном рандомизированном исследовании 21 тяжелого случая COVID-19 Darban et al. сообщили об отсутствии различий в насыщении кислородом, маркерах воспаления или продолжительности пребывания в отделении интенсивной терапии между пациентами, получавшими мелатонин, цинк и витамин С, добавленными к стандартному лечению, и пациентами, получавшими только стандартную помощь [ 274 ]. Аналогичным образом, в ретроспективном обсервационном исследовании Sánchez-Rico et al. продемонстрировали отсутствие влияния мелатонина на уровень смертности среди госпитализированных пациентов с COVID-19 [ 275 ]. Саху и др., другое ретроспективное исследование, рассматривали влияние мелатонина на противоположном конце спектра, показывая более длительную продолжительность пребывания в больнице среди пациентов, получающих мелатонин в дозах 6 и 9 мг/день, и отсутствие положительного влияния на уровень смертности [ 276] ]. Лучшим подходом к разрешению несоответствия эффекта мелатонина было бы проведение хорошо спланированных контролируемых исследований с выборками большего размера [ 277 ]. Несмотря на противоречивые клинические отчеты, исследования на животных подтверждают положительное влияние мелатонина. В мышиной модели COVID-19 K18-hACE2 2 дня до заражения мелатонином и 7 дней после заражения SARS-CoV2 минимизировали вирусную нагрузку головного мозга, повреждение мелких сосудов и воспаление головного мозга [ 278 ]. Кроме того, Ядалам и др. В исследовании in silico продемонстрировано значительное межмолекулярное взаимодействие мелатонина и агонистов его рецепторов, агомелатина и рамелтеона, с рецептор-связывающим доменом белка-шипа SARS-CoV-2 и рецепторами ACE2, что делает представление о том, что мелатонин препятствует развитию SARS. Проникновение в клетку CoV-2 более вероятно [ 279 ]. В том же свете использование мелатонина и агонистов его рецепторов до и после заражения SARS-CoV-2 у мышей K18-hACE2 привело к улучшению показателей выживаемости и более высоким клиническим показателям. Однако не было никаких изменений в панели плазменных цитокинов или маркерах воспаления в легких, за исключением более высокой экспрессии интерферона типа I и типа III (IFN) в легких при лечении мелатонином [ 280 ]. Несмотря на неоспоримые данные о том, насколько полезным может быть мелатонин во время инфекции COVID-19, использование мелатонина против последствий пост-COVID все еще остается неисследованной территорией как на клиническом, так и на экспериментальном уровне. Что может повысить шансы мелатонина, так это его история борьбы с множественными вирусными инфекциями в качестве поглотителя свободных радикалов, противовоспалительного и антиапоптотического средства [ 263 ], а также интригующее пересечение, которое он имеет с потенциальным патогенезом после COVID-19. и ферроптоз.
Мелатонин как ингибитор ферроптоза на траектории старения и нейродегенерации после COVID-19: механистическая гипотеза
Ферроптоз на траектории старения и нейродегенерации после COVID-19
Чтобы оценить потенциальный эффект мелатонина против ферроптоза, нам нужно сначала показать, как COVID-19 и его траектория пересекаются с ферроптозом. Мы предлагаем сложное пересечение пяти основных событий, которые облегчат возникновение ферроптоза, включая нейровоспаление, нарушение регуляции железа, GPX4/GSH/SLC7A11, антиоксидантную защиту, репрессию, события, зависящие от деградации рецепторов ACE2, и, наконец, нарушение часовых генов. Рис. 9 ).
Рис. 9
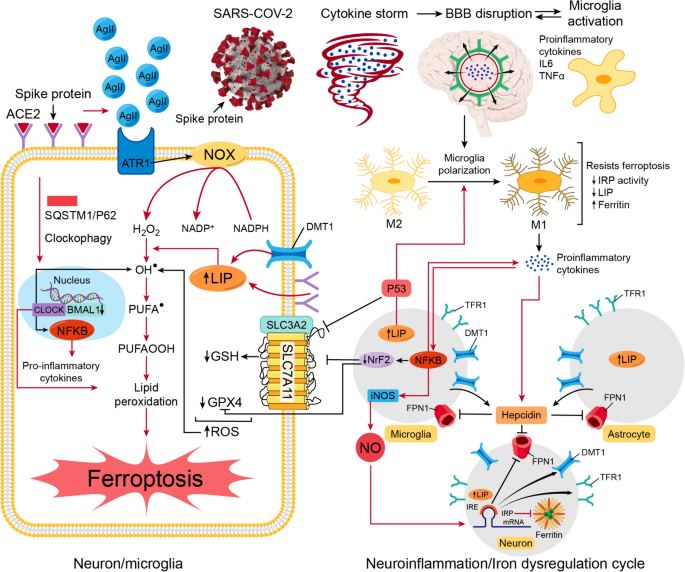
Ферроптоз как гипотетический механизм старения и нейродегенерации после COVID-19. При COVID-19 пять общих событий могут стать прелюдией к ферроптозу в пост-COVID-19. Это 1-нейровоспаление, 2-нарушение регуляции железа, 3-дисбаланс активных форм кислорода (АФК)/антиоксидантов, 4- нарушение ACE2/Ag II и 5-изменение гена Clock. 1. Цитокиновый шторм, вызванный SARS-CoV-2, разрушает ГЭБ, что позволяет провоспалительным цитокинам проникать в окрестности мозга и активировать микроглию. Провоспалительные ктокины способствуют поляризации микроглии от M2 (противовоспалительное) к M1 (провоспалительное). 2- IL-6 способствует выработке гепсидина микроглией и астроцитами. Гепсидин разрушает FPN1, который захватывает железо в нейронах, микроглии и, возможно, астроцитах. В микроглии, перегруженной железом, более высокий уровень LIP вызывает большую поляризацию микроглии, а NF-κB способствует выработке большего количества провоспалительных цитокинов и активирует iNOS, что увеличивает выработку NO. NO проникает в нейроны и модулирует молекулярный механизм регуляции железа путем повышения уровня IRP, что вызывает более высокую экспрессию DMT1 и TFR1 и более низкую экспрессию ферритина и FPN1. Это нарушение в белках, связанных с железом, увеличивает LIP и запускает порочный круг нарушения регуляции железа и нейровоспаления. 3- Более высокая экспрессия NF-κB снижает экспрессию NrF2. Перегрузка утюга активирует P53. Меньшее количество NrF2 и большее количество P53 подавляют экспрессию SLC7A11, что снижает выработку GSH. Меньшее количество NrF2 также может снизить выработку GPX4, ставя под угрозу антиоксидантную систему из-за более высокого содержания H2O2 и OH . ●производство, вызванное NOX и высоким LIP, соответственно. 4. Связывание белка-шипа с рецепторами ACE2 разрушает их, а Ag II накапливается и связывается с ATR1, активируя NOX и производя больше H2O2. 5. SARS-CoV-2 может вызывать аутофагическую деградацию/клотофагию BMAL1 и CLOCK, опосредованную рецептором груза SQSTM1/p62. Высокий уровень LIP, нарушение ACE2/ATR1, отказ антиоксидантной системы и дефицит BMAL1-CLOCK - все это будет способствовать прогрессирующему перекисному окислению липидов и ферроптозу, что приведет к ускорению старения и нейродегенерации. ROS: активные формы кислорода, ACE2: рецепторы ангиотензинпревращающего фермента 2, Ag II: ангиотензин II, SARS-CoV-2: коронавирус 2 тяжелого острого респираторного синдрома, BBB: гематоэнцефалический барьер, IL-6: интерлейкин-6, TNF-α : фактор некроза опухоли альфа, FPN1: ферропортин, LIP: пул лабильного железа, NF-κB: ядерный фактор-κB, iNOS: индуцибельная синтаза оксида азота, NO: оксид азота, IRP: регуляторный белок железа, IRE: железо-чувствительный элемент, мРНК : рибонуклеиновая кислота, DMT1: переносчик двухвалентных металлов 1, TFR1: рецепторы трансферрина-1, NrF2: фактор 2, связанный с ядерным фактором эритроида 2, P53: опухолевый белок p53, SLC7A11: член 11 семейства растворенных носителей 7, SLC3A2: семейство растворенных носителей 3 член 2, GSH: восстановленный глутатион, GPX4: глутатионпероксидаза 4, H202: перекись водорода, OH ● : гидроксильный радикал, PUFA ● : липидный радикал полиненасыщенных жирных кислот, PUFAOOH: липидный гидропероксидаза, NOX: никотинамидадениндинуклеотидфосфатоксидаза, НАДФН : никотинамидадениндинуклеотидфосфат, ATR1: рецептор ангиотензина 1, BMAL1: мозговой и мышечный ARNT-подобный 1 или белок 1, подобный ядерному транслокатору рецептора арилуглеводородов, CLOCK: капут циркадных двигательных циклов, SQSTM1/p62: секвестосома1
Полноразмерное изображение
У пациентов с COVID-19 измененный метаболизм железа, истощение GSH [ 281 ], инактивация GPX4 [ 282 ] и активация биомаркеров перекисного окисления липидов убедительно свидетельствуют о том, что ферроптоз является вероятным механизмом поражения многих органов при COVID-19, включая нервно-психические расстройства. последствия [ 283 ]. В модели ишемического инсульта ACSL4 способствовал повреждению головного мозга и нейровоспалению, вызванному ферроптозом, с результатами, аналогичными явлениям нейро-COVID-19, таким как увеличение размера инфаркта, снижение неврологической функции, активация микроглии и увеличение количества провоспалительных цитокинов (фактор некроза опухоли альфа). (TNF-α), IL-6 и IL-1β) [ 284 ]. В контексте COVID 19 мы можем видеть явные признаки нарушения функции железа наряду с нейровоспалением в нескольких формах. Высокие уровни сывороточного ферритина [ 285 ] и гепсидина [ 286 ], низкие уровни сывороточного железа [ 287 ] и низкая насыщенность трансферрина [ 288 ] значимо коррелируют с тяжестью COVID-19, госпитализацией и смертностью [ 289 , 290 , 291 ].
Цитокиновый шторм является характерным признаком инфекции SARS-CoV-2, провоцируя системное наводнение провоспалительными цитокинами, такими как IL-6, IL-1β, IL-8, IFN-γ и TNF-α [ 292 , 293 ]. Более того, цитокиновый шторм сосуществует с массовым увеличением числа коагулопатий и таких веществ острой фазы, как С-реактивный белок (СРБ) и сывороточный ферритин, которые коррелируют с тяжестью заболевания [ 294 , 295 , 296 ]. Высокие уровни периферических провоспалительных цитокинов нарушают целостность ГЭБ, проникают в окрестности мозга и активируют его резидентные иммунные клетки, вызывая активацию микроглии, что, в свою очередь, создает среду нейровоспаления [ 297 ].
Даже вне контекста COVID-19 воспаление тесно переплетено с изменением гомеостаза железа [ 298 ]. Условия инфекции и воспаления, особенно высокие уровни IL-6, имеют тенденцию увеличивать экспрессию гепсидина, который затем разрушает FPN1. Эта стратегия помогает секвестрации железа микроорганизмами за счет снижения системной доступности железа [ 299 , 300 , 301 , 302 ]. Однако накопление железа в клетках может иметь серьезные недостатки. В мозге двунаправленная связь между перегрузкой железом и нейровоспалением создает порочный круг, который в конечном итоге может привести к гибели нейронов, опосредованной ферроптозом. Сообщается, что в случаях нейровоспаления провоспалительные цитокины (например, IL-6, TNF-α) увеличивают экспрессию гепсидина микроглией и астроцитами, что, в свою очередь, ухудшает FPN1 как в клетках, так и в нейронах. Кроме того, провоспалительные цитокины способствуют сверхэкспрессии DMT1, что позволяет импортировать несвязанное с трансферрином железо во все три клетки. Однако манипуляция переносчиками железа через провоспалительные цитокины, по-видимому, влияет только на нейроны и микроглию, что приводит к клеточной перегрузке железом в этих специфических клетках [ 303 , 304 , 305 ]. Провоспалительные цитокины и перегрузка железом активируют микроглию и увеличивают ее поляризацию от противовоспалительного фенотипа (М2) к провоспалительному фенотипу (М1), что усугубляет выработку провоспалительных цитокинов, включая NO [ 306 ]. Железо и провоспалительные цитокины активируют транскрипционный фактор ядерного фактора-κB (NF-κB), который усиливает выработку индуцибельной синтазы оксида азота (iNOS), превращая аргиназу в NO [ 307 , 308 ]. Затем NO из активированной микроглии изменяет гомеостаз нейронального железа, воздействуя на систему IRE/IRP [ 298 , 309 ]. NO активирует IRP1, который останавливает трансляцию FPN1 и ферритина и способствует трансляции DMT1 и TfR1, способствуя увеличению клеточного пула лабильного железа, что запускает реакцию Фентона и опосредованную ферроптозом гибель нейронов [ 80 , 310 , 311 ]. Однако микроглия имеет тенденцию вести себя по-разному в отношении обращения с железом в зависимости от ее фенотипа, что влияет на ее чувствительность к ферроптозу. Микроглия M1 более устойчива к ферроптозу, чем микроглия M2, поскольку они имеют меньшую активность IRP и клеточный пул лабильного железа, а также более высокие уровни ферритина, которые помогают поддерживать нейровоспаление, закрепляют нарушение регуляции железа и опосредованную ферроптозом гибель нейронов [ 298 , 310 , 312 ].
Старение, включая старение мозга, представляет собой сложный процесс со множеством основных событий, таких как воспаление, окислительный стресс, метаболические нарушения, митохондриальная дисфункция, повреждение ДНК и иммуностарение, при котором клетки достигают SASP путем высвобождения цитокинов, хемокинов, факторов роста и реактивные метаболиты [ 313 , 314 , 315 ]. Этот многогранный процесс старения, по-видимому, идеально согласуется с большей частью патофизиологии COVID-19 [ 316 , 317 ]. Прогрессирующее, персистирующее системное воспаление с продолжающимся повышением уровня провоспалительных цитокинов, таких как IL-6, IL-1β, TNF-α и iNOS, сохраняет свои позиции как следствие инфекции COVID-19 [ 318 ] и как прелюдия к старению. , процесс, называемый воспалением [ 315 ]. В ретроспективной когорте из 272 госпитализированных пациентов с подтвержденным SARS-CoV-2 у пожилых пациентов (≥ 65 лет) были обнаружены сывороточные воспалительные цитокины, такие как IL-2R (рецепторы) и IL-6. Уровень IL-2R, IL-6, IL-8 и IL-10 был значительно выше у тяжелобольных пациентов в период с 1 по 5 неделю после заражения [ 319 ]. Кроме того, уровни IL-6, IL-8, IL-15 и белка, ингибирующего моноциты (MIP)-1β в спинномозговой жидкости были выше у пациентов с COVID-19 с неврологическими симптомами по сравнению с контрольной группой и пациентами с вирусом иммунодефицита человека (ВИЧ). разрушения ГЭБ [ 320 ]. Еще одним переломным моментом, где встречаются COVID-19 и старение, является нарушение регуляции железа. В процессе старения системная доступность железа имеет тенденцию к снижению с увеличением уровня внутриклеточного железа, что создает угрозу провоцирования ферроптоза. Внутриклеточный захват железа возникает из-за снижения регуляции FPN1 с высокими уровнями гепсидина из-за хронического воспаления, связанного со старением [ 321 , 322 , 323 , 324 , 325 , 326 ]. Нарушение регуляции железа тесно связано с преждевременным фенотипом старения, называемым ферростарением, который запускается внутриклеточной задержкой железа. Этот тип старения характеризуется повреждением ДНК, укорочением теломер и дефектами метилирования [ 327 ], о которых сообщалось у пациентов с COVID-19 [ 113 ]. Дисфункция теломер, по-видимому, активирует клеточные реакции p53 [ 328 ]. P53 является ключевым регулятором механизмов репарации ДНК клеток; однако воспалительные реакции, связанные с вирусной инфекцией, могут привести к постоянной активации р53 [ 317 ]. Кроме того, перегрузка железом имеет тенденцию активировать ацетилирование р53 и опосредовать поляризацию макрофагов М1 р53-зависимым образом, поддерживая провоспалительные реакции [ 329] .]. Также сообщалось о опосредованной NCOA4 деградации ферритина в мозге стареющих мышей [ 330 ].
Массивный цитокиновый шторм, связанный с инфекцией COVID-19, вызывает нейровоспаление, напоминающее одно из ключевых событий, способствующих нейродегенерации [ 331 ]. Мозг при болезни Альцгеймера отражает высокие уровни провоспалительных цитокинов, включая IL-6, IL-1β и TNF-α, секретируемых активированной микроглией [ 332 , 333 ]. Нарушение регуляции железа тесно связано с нейродегенерацией. При аутопсии головного мозга при болезни Альцгеймера уровень железа в мозге значительно повышен в различных областях коры, при этом наблюдается сильная связь между содержанием железа в мозге и снижением когнитивных функций [ 334 ]. Железо присутствует в нейрофибриллярных клубках и ускоряет фосфорилирование тау [ 335 ]. Бао и др. сообщили о подавлении FPN1, единственного клеточного экспортера железа, в гиппокампе мышиной модели APPswe/PS1dE9 AD и в тканях головного мозга пациентов с AD. Они разработали условную модель мыши FPN1 KO, в которой FPN1 удален в основных нейронах гиппокампа и неокортекса. Дефицит FPN1 привел к когнитивным нарушениям и явному увеличению маркеров ферроптоза. Кроме того, использование ингибиторов ферроптоза уменьшало вызванную Aβ гибель нейронов и дефицит памяти [ 101 ]. Ферроптоз оказался вероятным виновником патологии AD. При БА перегрузка железом активирует микроглию, которая поддерживает нейровоспаление и связанную с АД агрегацию белков. Железо активирует NF-κB в микроглии, что запускает выработку провоспалительных цитокинов, включая NO. NO может сделать микроглию устойчивой к ферроптозу, что обеспечивает ее непрерывную воспалительную реакцию, нанося вред нейронам и способствуя их гибели, опосредованной ферроптозом [ 310 ].
Помимо злонамеренного порочного круга нарушения регуляции железа и нейровоспаления, SARS-CoV-2 делает клетки уязвимыми к АФК и перекисному окислению липидов за счет разрушения антиоксидантной защиты и ингибирования механизма GPX4/GSH. Кроме того, SLC7A11, по-видимому, участвует в потенциальном ферроптозе, опосредованном SARS-CoV-2 [ 336 , 337 , 338 ]. Сообщается, что активация P53 играет важную роль в контексте старения, связанного с ферроптозом. Активация P53 опосредует ферроптоз путем подавления транскрипции SLC7A11 или системы Xc-, что приводит к дефициту цистеина, истощению GSH и ферроптозу [ 339 , 340 ]. Более интересно, что более высокий пул лабильного железа с деградацией ферритина, как сообщается, усиливает p53/SLC7A11-опосредованный ферроптоз [ 341 ]. Сообщалось, что экспрессия р53, вызванная перегрузкой железом, способствует ферроптозу, опосредованному репрессией SLC7A11, в стареющих нейронах и мышцах [ 342 , 343 ]. Транскрипционный фактор NrF2 выступает противником репрессии, опосредованной SLC711-p53, поскольку он способствует экспрессии SLC7A11 в качестве одного из его генов-мишеней, который противостоит ферроптозу [ 344 ]. Кроме того, NrF2 увеличивает экспрессию H-ферритина, который способствует внутриклеточному хранению железа в виде ферритина и уменьшает пул лабильного железа [ 105 ], благородная роль которого облегчает старение мозга, связанное с железом [ 345 ], а его отсутствие может способствовать преждевременному старению мозга. старение [ 346 ]. В соответствии с представлением о взаимосвязанных событиях старения и инфекции COVID-19, у пациентов с COVID-19 было зарегистрировано подавление NrF2-зависимой экспрессии генов, а агонисты NrF2 останавливали репликацию SARS-CoV-2 [ 347 ]. Более того, активация р53 участвует в нейротоксичности, опосредованной спайковым белком SARS-CoV-2 [ 348 ]. Более высокая экспрессия р53 и р21, маркеров старения, опосредовала старение пигментных эпителиальных клеток сетчатки, обработанных шиповидным белком SARS-CoV-2 [ 349 ]. Нейродегенерация у пациентов с COVID-19 является потенциальным последствием истощения GSH и инактивации GPX4 [ 350 ], что может способствовать перекисному окислению липидов и ферроптозу [ 283 ]. Синтез GSH при БА нарушается и связан с ухудшением патологии. Тиоредоксин нарушает важный этап образования GSH, и его уровень снижается при болезни Альцгеймера [ 351 ]. Чанг и др. сообщили о более низких уровнях общего глутатиона в областях мозга у пациентов с AD с отложением амилоидных бляшек [ 352]. В 5xFAD, пяти семейных мутациях, связанных с AD, на мышиной модели AD, у мышей были обнаружены маркеры перекисного окисления липидов и ферроптоза наряду со снижением когнитивных функций, которое улучшилось с созданием трансгенных мышей 5xFAD, которые сверхэкспрессируют GPX4 [ 353 ], демонстрируя решающую роль GPX4. в опосредовании нейродегенерации, вызванной ферроптозом.
Продолжение: https://budetlyanin108.livejournal.com/3762419.html?newpost=1