Гинцбург назвал сроки разработки вакцины от омикрон-штамма коронавируса

Разработка новой версии вакцины против омикрон-штамма коронавируса займёт не более десяти дней, еще 45-50 дней нужно на регуляторные процедуры, заявил директор НИЦ эпидемиологии и микробиологии имени Гамалеи Александр Гинцбург, сообщает РИА VladNews со ссылкой на РИА Новости.
«Сама экспериментальная работа по получению нового вакцинного препарата займёт не более десяти дней, всё остальное приходится на регуляторику, то есть, разрешительные процедуры и доказательство того, что данная вакцина является безопасной и иммуногенной», ̶ сказал он.
Академик уточнил, что в обычной ситуации регуляторные процедуры занимают около 2,5 месяца, но в условиях чрезвычайной ситуации можно уложиться в 45-50 дней.
При этом обсуждать замену вакцины можно будет только после получения более полных данных о новом штамме, подчеркнул Гинцбург.
В центре Гамалеи по-прежнему считают существующие российские вакцины от коронавируса «Спутник V» и «Спутник Лайт» эффективными против «омикрона». Несмотря на это, НИЦ начал их адаптацию, согласно протоколам для штаммов, признанных «вызывающими озабоченность».
Как заявляют в фонде, маловероятно, что такая модификация потребуется. Однако, по его оценке, в этом случае новая версия «Спутника» будет готова к массовому производству через 45 дней. На международный рынок несколько сотен бустеров могут вывести уже к 20 февраля 2022 года.
ОТСЮДА
Российские вакцины не прошли все фазы клинического исследования
Клиническое исследование лекарственного препарата - изучение диагностических, лечебных, профилактических, фармакологических свойств лекарственного препарата в процессе его применения у человека, животного, в том числе процессов всасывания, распределения, изменения и выведения, путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного препарата, данных о нежелательных реакциях организма человека, животного на применение лекарственного препарата и об эффекте его взаимодействия с другими лекарственными препаратами и (или) пищевыми продуктами, кормами. (Федеральный закон от 12.04.2010 N 61-ФЗ "Об обращении лекарственных средств" Статья 4 Пункт 41)
Клинические исследования во всем мире являются неотъемлемым этапом разработки препаратов, который предшествует его регистрации и широкому медицинскому применению. В ходе клинических исследований новый препарат изучается для получения данных о его эффективности и безопасности. На основании этих данных уполномоченный орган здравоохранения принимает решение о регистрации препарата или отказе в регистрации.
Проведение клинических исследований в РФ регламентируют: Федеральный закон от 12.04.2010 N 61-ФЗ "Об обращении лекарственных средств" (Статья 40. Проведение клинического исследования лекарственного препарата для медицинского применения), ГОСТ Р 56701-2015 от 2016-07-01 ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ (УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 11 ноября 2015 г. N 1762-ст.), ГОСТ Р 52379-2005 от 2006-04-01 НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКА (УТВЕРЖДЕН Приказом Федерального агентства по техническому регулированию и метрологии от 27 сентября 2005 года N 232-ст), Правила надлежащей клинической практики ОСТ 42-511-99 (согласно международного стандарта этических норм и качества научных исследований Good Clinical Practice; GCP), Приказ Минздрава России от 01.04.2016 N 200н "Об утверждении правил надлежащей клинической практики" (Зарегистрировано в Минюсте России 23.08.2016 N 43357), приказ Минздрава России от 09.01.2014 № 2н «Об утверждении порядка проведения оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий».
Обычно выделяют четыре фазы клинических испытаний. Фаза I. Цель этапа - убедиться, что препарат можно применять у людей. Фаза II. Цель этапа - дополнительно оценить безопасность лекарства и выяснить, работает ли препарат. Фаза III. Цель этапа - сравнить новый препарат со стандартным лечением. Фаза IV называется постмаркетинговой - этот этап клинического испытания начинается, когда готовое лекарство уже поступает в продажу.
Существует государственный реестр лекарственных средств, который содержит перечень лекарственных препаратов, прошедших государственную регистрацию (Федеральный закон от 12.04.2010 N 61-ФЗ "Об обращении лекарственных средств" Статья 33), другими словами реестр разрешений на проведение клинических исследований (РКИ).
В настоящий момент, у Российской Федерации известно существование нескольких вакцин от коронавируса: «Спутник V» и «Спутник Лайт» («Гам-КОВИД-Вак», Национального исследовательского центра эпидемиологии и микробиологии имени Н. Ф. Гамалеи), «ЭпиВакКорона» (Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии Вектор» Роспотребнадзора), «КовиВак» (Федерального научного центра исследований и разработки иммунобиологических препаратов имени М.П. Чумакова Российской академии наук).
«КовиВак» на сайте государственного реестра лекарственных средств.

Тут так же видно, что проводится фаза клинического исследования 3 с участием добровольцев от 18 до 60 лет, и завершится она 30 декабря 2022 года.
«Спутник Лайт» на сайте государственного реестра лекарственных средств.
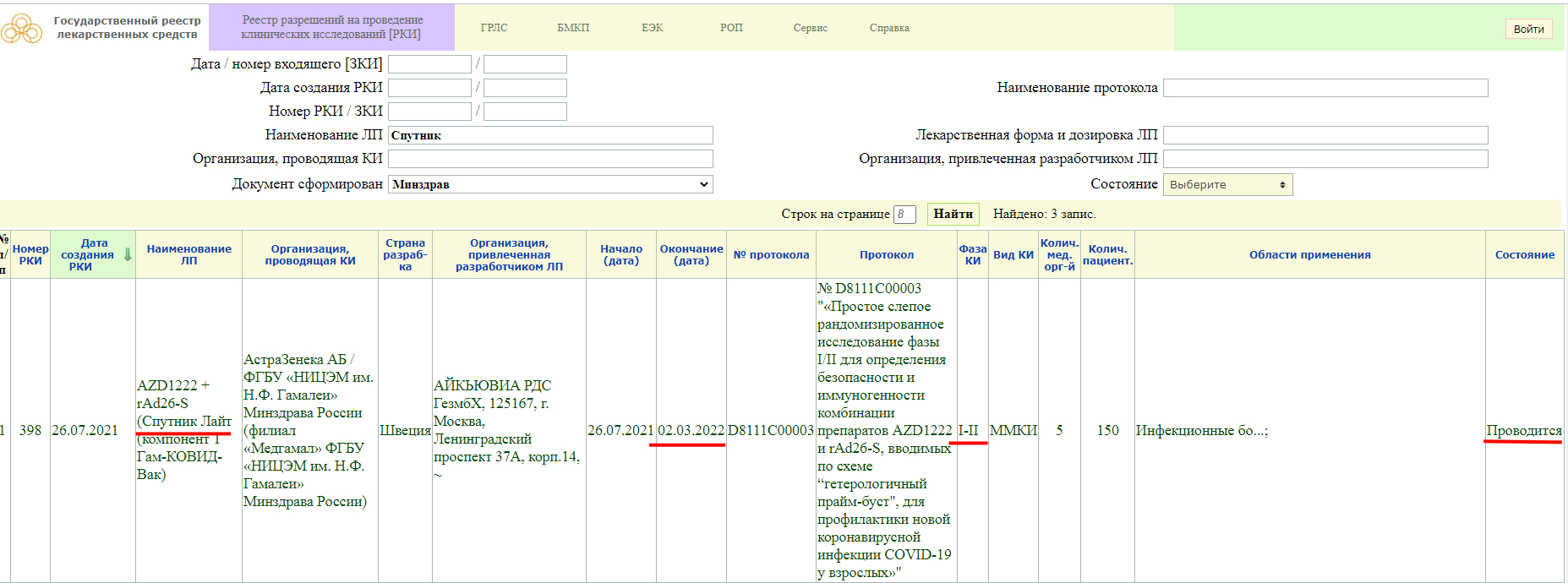
Как мы видим, в настоящий момент, у «Спутника Лайт» проводится фаза клинического исследования 1-2, и завершится она 2 марта 2022 года. Кстати обратите внимание, страна разработки Швеция.
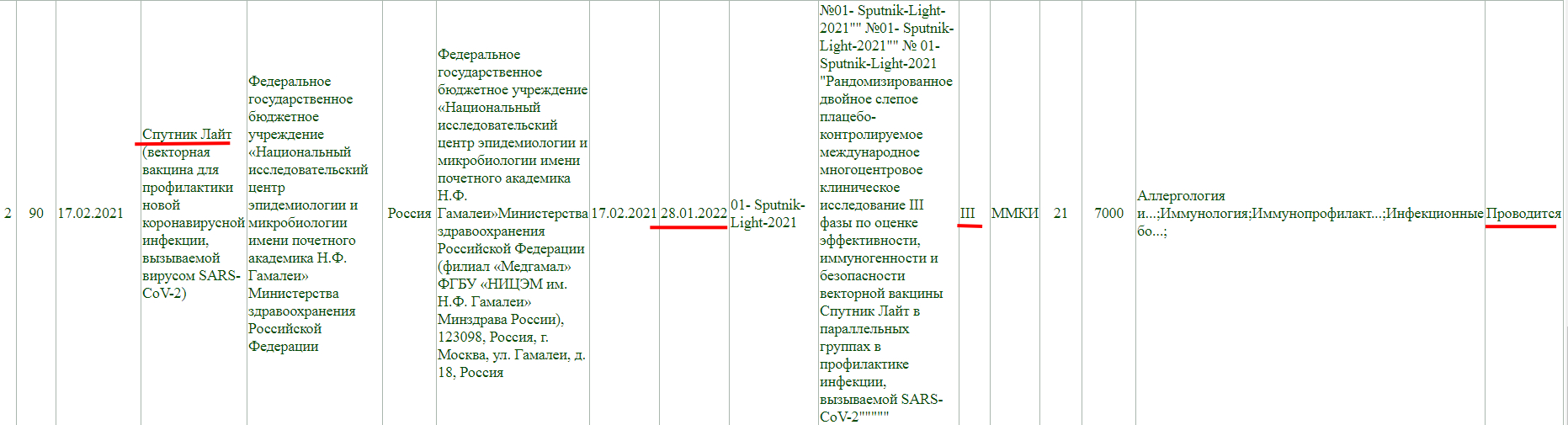
Так же, проводится фаза клинического исследования 3, и завершится она 28 января 2022 года.

Фаза клинического исследования 1-2, проводится до 31 декабря 2021 года.
В том числе и "Спутник V" («Гам-Ковид-Вак») на сайте государственного реестра лекарственных средств.
Важно отметить, что согласно разъяснениям Минздрава: «Гам-Ковид-Вак» и «Спутник V» - это одна и та же вакцина, у которой есть медицинское и коммерческое названия. Всем знакомая и понятная фраза «Спутник V» является торговым наименованием «Гам-Ковид-Вак.

Как и у остальных, клинические исследования не завершены, и в настоящий момент проводится фаза 3 с участием добровольцев от 18 до 60 лет, а завершится она 30 декабря 2022 года.
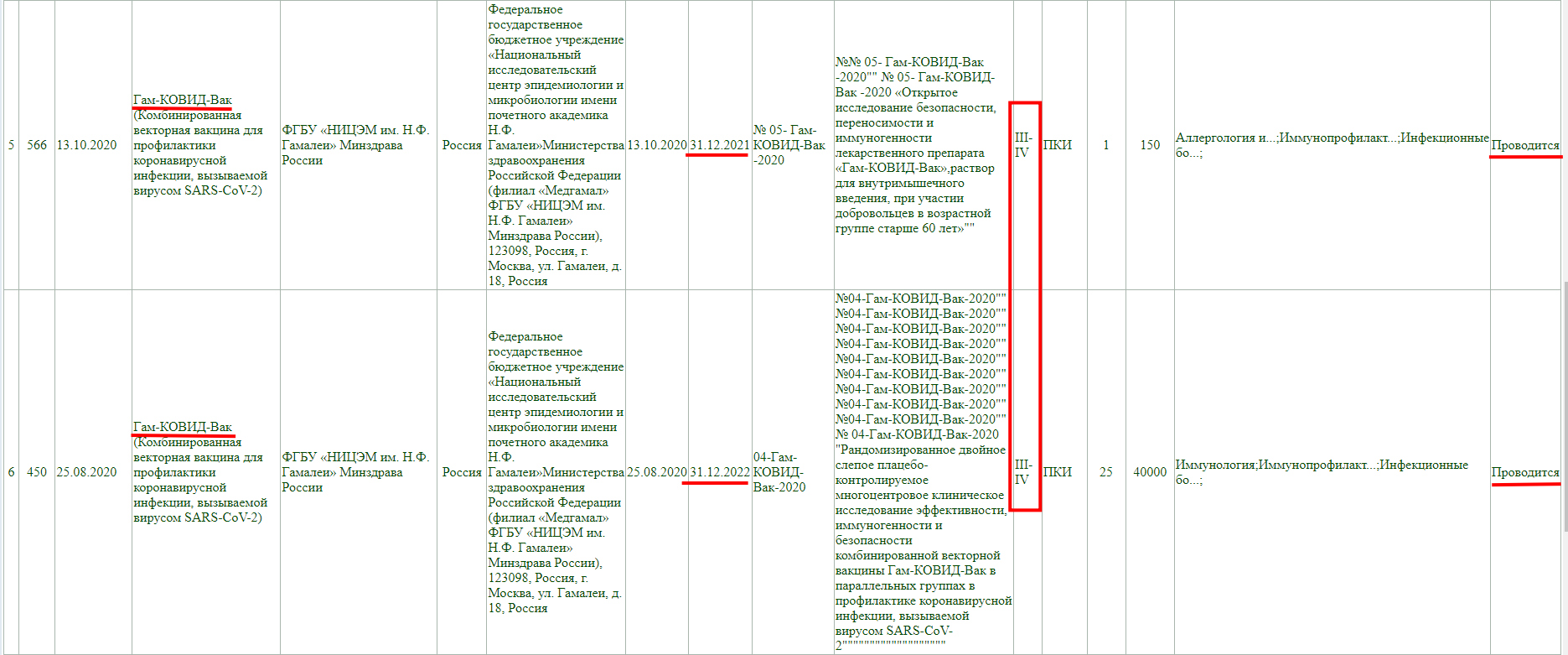
Тут аналогично, клинические исследования не завершены, проводится фаза 3-4, и завершится она 30 декабря 2022 года.
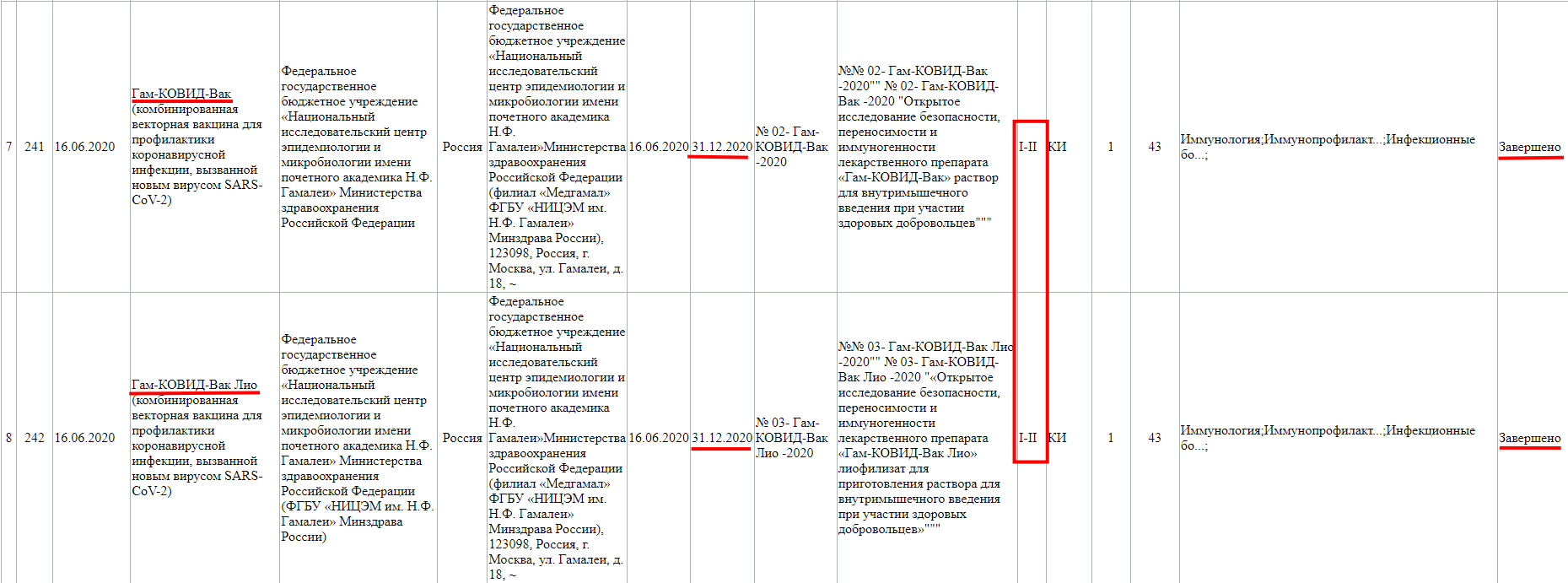
А тут клиническое исследование завершено, но только фазы 1-2.
Кроме того, отсутствие данных о клинических испытаниях вакцины «Спутник V» необходимых для ее регистрации в Европе, 15 мая 2021 года, уже сообщало одно из крупнейших в мире международных агентств новостей и финансовой информации, Reuters.
И в завершение, по данным ВОЗ на 1 декабря 2021 г., российские вакцины против COVID-19, в перечне безопасных и эффективных, отсутствуют.
ОТСЮДА