Ивермектин: загадочный многогранный "чудо-препарат" продолжает удивлять и превосходить ожидания
За последнее десятилетие мировое научное сообщество начало признавать непревзойденную ценность необычного препарата ивермектина, который происходит из одного микроба, обнаруженного в почве в Японии. Работа над ивермектином привела к тому, что его первооткрыватель Сатоши Омура из престижного Токийского института Китасато получил Глобальную премию Гейрднера за 2014 год и Нобелевскую премию по физиологии и медицине за 2015 год, которой он поделился с партнером по сотрудничеству в открытии и разработке препарата Уильямом Кэмпбеллом из Merck & Co.
Сегодня ивермектин продолжает удивлять и восхищать ученых, предлагая все больше и больше возможностей помочь улучшить глобальное общественное здравоохранение путем лечения широкого спектра заболеваний, причем его неожиданный потенциал в качестве антибактериального, противовирусного и противоракового средства особенно экстраординарен.
Уникальный и необычный микроорганизм, который производит авермектины (из которых получают ивермектин), был обнаружен Омурой в 1973 году (рис.1). Он был отправлен в лаборатории Merck для прохождения через специализированный экран для антигельминтиков в 1974 году, а авермектины были найдены и названы в 1975 году. Более безопасное и эффективное производное, ивермектин, впоследствии было коммерциализировано, поступив на рынки ветеринарии, сельского хозяйства и аквакультуры в 1981 году. Потенциал препарата для здоровья человека был подтвержден несколько лет спустя, и он был зарегистрирован в 1987 году и немедленно предоставлен бесплатно (под брендом "Мектизан")- "столько, сколько необходимо, столько, сколько необходимо" -с целью оказания помощи в борьбе с онхоцеркозом (также известным как Речная слепота) среди бедного населения во всех тропиках. Вскоре последовало использование пожертвованного ивермектина для борьбы с другими так называемыми "забытыми тропическими болезнями", в то время как коммерчески доступные продукты были представлены для лечения других заболеваний человека.
Рисунок 1

Сатоши Омура собирает почву с того самого места, где в 1973 году был взят образец, содержащий Streptomyces avermectinius (S. avermitilis). (Фото: Энди Крамп).
Многие превосходные, красноречивые и всеобъемлющие обзоры, посвященные открытию, появлению, разработке, производству и распространению ивермектина, были опубликованы теми, кто тесно связан с различными этапами.1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14
Сегодня ивермектин остается относительно неизвестным препаратом, хотя немногие другие препараты, если таковые имеются, могут соперничать с ивермектином по его благотворному влиянию на здоровье и благополучие человека. Ивермектин в основном используется у людей в качестве перорального лекарства для лечения филярийных заболеваний, но также эффективно против других инфекций и заболеваний, связанных с червями, а также ряда эпидермальных паразитарных заболеваний кожи, вызванных паразитами, а также нашествий насекомых. Он одобрен для использования человеком в нескольких странах для лечения онхоцеркоза, лимфатического филяриоза (также известного как слоновая болезнь), стронгилоидоза и/или чесотки и, совсем недавно, для борьбы с головными вшами. Однако медицинские работники все чаще используют его несанкционированным образом для лечения широкого спектра других заболеваний, как показано в Приложении 1.
Когда были открыты авермектины, они представляли собой совершенно новый класс соединений, "эндектоцидов", названных так потому, что они убивали широкий спектр болезнетворных организмов-а также переносчиков патогенов-как внутри, так и снаружи организма. Первые публикации об авермектине появились в 1979 году, описывая его как сложную смесь 16-членных макроциклических лактонов, полученных в результате ферментации актиномицета Streptomyces avermitilis-позже переклассифицированного как S. avermectinius (рисунок 2). Семейство авермектинов проявляло необычайно мощные антигельминтные свойства.15, 16, 17 Ивермектин является более безопасной, более мощной полусинтетической смесью двух химически модифицированных авермектинов, содержащей 80% 22,23-дигидроавермектина-B1a и 20% 22,23-дигидроавермектина-B1b (рисунок 3).
Рисунок 2
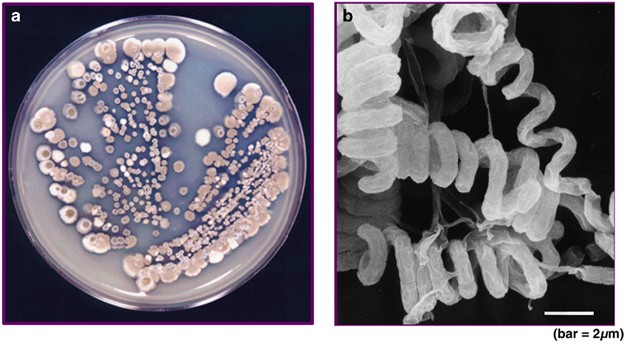
S. avermitilis, единственный источник авермектинов: (а) колония и (б) фотомикрография. (Фото: Институт Китасато).
Рисунок 3
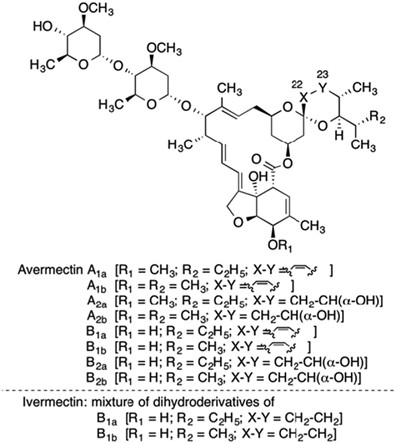
Молекулярная структура авермектина, комплекса из нескольких соединений, которые затем подверглись химической модификации с получением ивермектина, комбинации двух дигидропроизводных.
Ивермектин стал для меня откровением. Он обладал широким спектром действия, был высокоэффективен, надежно действовал в низких дозах против широкого спектра нематод, насекомых и акариновых паразитов. Он оказался чрезвычайно эффективным против большинства распространенных кишечных червей (за исключением ленточных червей), мог вводиться перорально, местно или парентерально и не проявлял признаков перекрестной резистентности с другими широко используемыми антипаразитарными соединениями. Выпущенный на рынок в 1981 году, он быстро стал использоваться во всем мире для борьбы с филяриозными и другими инфекциями и инвазиями домашнего скота и домашних животных.
Зарегистрированный для использования человеком в 1987 году, ивермектин был немедленно передан в виде таблеток Мектизана для использования исключительно для борьбы с онхоцеркозом
В середине 1990-х годов было установлено, что ивермектин является отличным средством для лечения лимфатического филяриоза
Рисунок 4

(а) Африканский мужчина со слепотой, повреждением кожи и обезображиванием из-за онхоцеркоза и лимфатического филяриоза. b) Дистрибьютор ивермектина, ориентированный на сообщество, предлагает применение комбинации ивермектина с альбендазолом, используемой для лечения и защиты людей в районах, где сосуществуют эти два заболевания-оба заболевания могут быть устранены как проблемы общественного здравоохранения в течение десятилетия. (Фото в титрах: Энди Крамп).
Массовое применение ивермектина также обеспечивает значительные вторичные преимущества для здоровья и социально-экономического развития в масштабах всего сообщества благодаря его воздействию на нецелевые инфекции.13 В течение 1995-2010 годов было подсчитано, что годы жизни с поправкой на инвалидность, предотвращенные в результате воздействия на эти нецелевые заболевания, добавили еще 500 000 лет жизни с поправкой на инвалидность к 19,1 миллионам лет Африканской программы по борьбе с онхоцеркозом, сэкономленных благодаря вмешательствам по борьбе с онхоцеркозом.27
Удивительно, но, несмотря на 40-летний непревзойденный глобальный успех, а также широкое распространение интенсивных научных исследований как в государственном, так и в частном секторах, ученые до сих пор не уверены в том, как именно действует ивермектин.
Настоящее: загадка
Авермектины усиливают нейротрансмиссию, разрушая глутамат-зависимые хлоридные каналы, а также оказывают незначительное воздействие на рецепторы γ-аминомасляной кислоты (ГАМК). Они нарушают нейротрансмиссию в нервных и мышечных клетках, вызывая гиперполяризацию нейрональной мембраны, вызывая паралич соматических мышц, особенно глоточного насоса, убивая паразитов. ГАМК-связанные каналы являются обычным явлением у нематод и насекомых, в то время как у млекопитающих ГАМК-рецепторы и нейроны ограничены центральной нервной системой. Поэтому ивермектин очень безопасен для позвоночных, так как он не может пересечь гематоэнцефалический барьер.
Способ действия ивермектина против паразитов в организме человека еще предстоит выяснить. Существует существенное несоответствие между максимальными концентрациями в плазме крови после введения ивермектина и концентрациями, необходимыми для индуцирования паралича у микрофилярий. Накапливается поддержка подтвержденной гипотезы о том, что клиренс микрофилярий регулируется иммунорегуляторными процессами
.Высокая растворимость ивермектина в липидах приводит к его широкому распространению по всему организму. После перорального введения средняя пиковая концентрация в плазме происходит примерно через 4 ч после приема, второй пик через 6-12 ч, вероятно, возникает из-за энтерогепатической рециркуляции препарата, при этом период полураспада ивермектина в плазме составляет около 12 ч.32, 33, 34
Основной мишенью ивермектина являются глутамат-зависимые хлоридные каналы, хотя он также активен в отношении других рецепторов нейромедиаторов беспозвоночных, включая ГАМК-, гистамин - и рН-чувствительные хлоридные каналы.35, 36, 37 Кроме того, воздействие ивермектина изменяет экспрессию генов, участвующих в механизме размножения самок червей, даже при низких концентрациях.38, 39
В последнее время исследования показали, что активность глутамат-закрытых хлоридных каналов выражается исключительно в мышцах, окружающих выделительно-секреторный пузырь филярии, что предполагает, что химические вещества, происходящие из выделительно-секреторного пузырька, регулируются активностью.40 Все чаще считается, что быстрый микрофиляриальный клиренс после дозирования ивермектина является результатом не прямого воздействия препарата, а подавления способности паразита уклоняться от естественного иммунного защитного механизма хозяина.41, 42, 43, 44, 45, 46, 47, 48, 49 Иммуномодулирующие агенты часто проявляют меньше побочных эффектов, чем лекарственные препараты, а также создают меньше возможностей для создания устойчивости у микроорганизмов-мишеней, что помогает объяснить отсутствие лекарственной устойчивости у людей.
Будущее: новые потенциальные/новые целевые заболевания
Ивермектин зарегистрирован для применения у людей главным образом для лечения онхоцеркоза и стронгилоидоза, а также в комбинации с альбендазолом для борьбы с лимфатическим филяриозом, а также все чаще используется "без этикетки" для борьбы с целым рядом других заболеваний. Пероральное лечение является обычным явлением, но дозы ивермектина также успешно вводились в прямую кишку, подкожно и местно (рис. 5). Ивермектин в настоящее время используется на протяжении более трех десятилетий для лечения паразитарных инфекций у млекопитающих и обладает чрезвычайно хорошим профилем безопасности, при этом в многочисленных исследованиях сообщалось о низких показателях нежелательных явлений при пероральном лечении паразитарных инфекций.50 Было зарегистрировано несколько проблемных реакций, но они, как правило, протекают в легкой форме и обычно не требуют отмены препарата.
Рисунок 5
Ниже приведены данные, свидетельствующие о различном потенциале борьбы с болезнями, который был выявлен для ивермектина до сих пор:
Миаз
.52
Трихинеллез 53
Малярия
.56, 57, 58, 59 .60, 61 .62
Лейшманиоз.63, 64 .65, 66 .60 67
Африканский трипаносомоз (сонная болезнь)
70
Американский трипаносомоз (болезнь Шагаса)
71
Шистосомоз
74, 75и.76, 77 .78, 79
Розацеа
Хотя антипаразитарные эффекты ивермектина широкого спектра действия хорошо документированы, его противовоспалительная способность была выявлена лишь относительно недавно. 81 82, которое недавно получило одобрение американских и европейских властей для лечения взрослых с поражениями розацеа.
Астма
В исследовании 2011 года изучалось влияние ивермектина на симптомы аллергической астмы у мышей и было обнаружено, что ивермектин (в дозе 2 мг кг−1) значительно сокращал набор иммунных клеток, выработку цитокинов в жидкостях бронхоальвеолярного лаважа и секрецию специфичных для овальбумина IgE и IgG1 в сыворотке. Ивермектин также подавлял гиперсекрецию слизи бокаловидными клетками, доказывая, что ивермектин может эффективно подавлять воспаление, так что он может быть полезен при лечении аллергической астмы и других воспалительных заболеваний дыхательных путей.83
Эпилепсия
.84, 85 86. 87.84 .88, 89, 90 и.91
Неврологичские болезни
Многие неврологические расстройства, такие как заболевания двигательных нейронов, возникают из-за гибели клеток, инициированной чрезмерным уровнем возбуждения в нейронах центральной нервной системы. Предлагаемая новая терапия этих расстройств включает в себя подавление чрезмерной активности нейронов с помощью ивермектина. Из-за своего действия на рецепторы P2X4 ивермектин обладает потенциалом в отношении профилактики расстройств употребления алкоголя92, а также заболеваний двигательных нейронов.93 Действительно, в 2007 году бельгийские ученые подали заявку на патент "Использование ивермектина и его производных для лечения бокового амиотрофического склероза" (Номер публикации: WO/2008/034202A3), чтобы охватить "использование ивермектина и его аналогов для профилактики, замедления и улучшения заболевания двигательных нейронов, такого как боковой амиотрофический склероз и связанная с ним дегенерация двигательных нейронов".
Недавняя работа прояснила, как ивермектин связывается с рецепторами-мишенями, и помогла объяснить его селективность в отношении рецепторов Cys-петли беспозвоночных. В сочетании с появляющейся геномной информацией теперь можно предсказать чувствительность видов к ивермектину, и молекулярная основа устойчивости к ивермектину стала более ясной. У людей рецепторы нейромедиаторов Cys-петли, особенно те, которые активируются ГАМК, опосредуют быструю синаптическую передачу по всей нервной системе и имеют решающее значение для межклеточной коммуникации. Они являются ключевыми факторами в фундаментальных физиологических процессах, таких как обучение и память, а также в ряде неврологических расстройств, что делает их привлекательными мишенями для лекарств.94 Улучшенное понимание стереохимии связывания ивермектина будет способствовать разработке новых соединений свинца, как антигельминтных средств, а также методов лечения широкого спектра неврологических расстройств у человека.95, 96
Противовирусные (например, ВИЧ, лихорадка денге, энцефалит)
Недавние исследования опровергли мнение, существовавшее в течение большей части последних 40 лет, о том, что ивермектин был лишен каких-либо противовирусных свойств. Было обнаружено, что ивермектин эффективно ингибирует репликацию вируса желтой лихорадки, при этом значения EC 50 находятся в субнаномолярном диапазоне. Он также ингибирует репликацию в нескольких других флавивирусах, включая лихорадку денге, японский энцефалит и клещевой энцефалит, вероятно, путем воздействия на активность неструктурной 3 геликазы.97 Ивермектин ингибирует вирусы лихорадки денге и прерывает репликацию вирусов, обеспечивая защиту от заражения всеми различными серотипами вирусов и обладает неизученным потенциалом в качестве противовирусного средства против лихорадки денге.98
Также было продемонстрировано, что ивермектин является мощным специфическим ингибитором широкого спектра действия α/β-опосредованного импорта ядерного транспорта и демонстрирует противовирусную активность в отношении нескольких РНК-вирусов, блокируя ядерный транспорт вирусных белков. Было показано, что он оказывает мощное противовирусное действие против вирусов ВИЧ-1 и лихорадки денге, оба из которых зависят от суперсемейства белков импортина для нескольких ключевых клеточных процессов. Ивермектин может иметь важное значение для разрушения интегразы ВИЧ-1 в ВИЧ-1, а также полимеразы NS-5 (неструктурный белок 5) в вирусах денге.99, 100
Антибактериальные (туберкулез и язва Бурули)
До недавнего времени считалось, что авермектины также не обладают антибактериальной активностью. Однако в 2012 году появились сообщения о том, что ивермектин способен предотвращать инфицирование эпителиальных клеток бактериальным патогеном Chlamydia trachomatis, и делать это в дозах, которые могут быть использованы для борьбы с инфекциями, передающимися половым путем, или глазными инфекциями.101 В 2013 году исследователи подтвердили, что ивермектин обладает бактерицидным действием в отношении целого ряда микобактериальных организмов, включая штаммы микобактерий туберкулеза с множественной лекарственной устойчивостью и широкой лекарственной устойчивостью, авторы предполагают, что ивермектин может быть повторно использован для лечения туберкулеза. Хотя другие исследователи обнаружили, что ивермектин не обладает противотуберкулезной активностью, позже было показано, что результаты несопоставимы из-за различий в методах тестирования, при этом первоначальные результаты были подтверждены дальнейшей работой в Японии.102, 103, 104 К сожалению, потенциальное использование ивермектина для лечения туберкулеза сомнительно из-за возможной нейротоксичности при высоких дозировках. Сообщалось также,что ивермектин обладает бактерицидным действием против M. ulcerans,105 хотя другие исследователи не обнаружили значительной активности против этой бактерии.106
Противораковое средство
Существует постоянно накапливающийся массив доказательств того, что ивермектин может иметь существенную ценность в лечении различных видов рака. Известно,что авермектины обладают выраженной противоопухолевой активностью107, а также способностью потенцировать противоопухолевое действие винкристина на карциному Эрлиха, меланому В16 и лимфоидный лейкоз Р388, включая устойчивый к винкристину штамм Р388.108
За последние несколько лет постоянно растет число сообщений о том, что ивермектин может по-разному применяться в качестве противоракового средства, поскольку было доказано, что он обладает как противораковыми, так и противораковыми свойствами стволовых клеток. Подход в области химической геномики, разработанный для прогнозирования того, могут ли какие-либо существующие препараты быть полезными в борьбе с глиобластомой, раком легких и молочной железы, показал, что ивермектин может быть полезным соединением в этом отношении.109
В клеточных линиях рака яичников человека и опухолевых клеток NF2 ивермектин в высоких дозах инактивирует протеинкиназу PAK1 и блокирует PAK1-зависимый рост. Белки PAK необходимы для реорганизации цитоскелета и передачи ядерных сигналов, PAK1 участвует в генезе опухоли, в то время как ингибирование сигналов PAK1 вызывает апоптоз опухолевых клеток (гибель клеток).
PAK1 необходим для роста более 70% всех видов рака у человека, включая рак молочной железы, предстательной железы, поджелудочной железы, толстой кишки, желудка, легких, шейки матки и щитовидной железы, а также гепатому, глиому, меланому, множественную миелому и опухоли нейрофиброматоза.110
Во всем мире рак молочной железы является наболее распространенным видом рака среди женщин, но вариантов лечения мало. Ивермектин подавляет рак молочной железы путем активации цитостатической аутофагии, нарушая при этом клеточную передачу сигналов, вероятно, за счет снижения экспрессии PAK1. Индуцированная ивермектином цитостатическая аутофагия также приводит к подавлению роста опухоли в ксенотрансплантатах рака молочной железы, что заставляет исследователей полагать, что ивермектин может использоваться для ингибирования пролиферации клеток рака молочной железы и что препарат является потенциальным средством лечения рака молочной железы.111 Тройноотрицательные формы рака молочной железы, в которых отсутствуют рецепторы эстрогена, прогестерона и HER2, составляют 10-20% случаев рака молочной железы и связаны с плохим прогнозом. Тесты с использованием пептида, соответствующего домену взаимодействия SIN3 (SID) MAD, обнаружили, что пептид SID избирательно блокирует связывание белков, содержащих SID, с парным доменом α-спирали SIN3, что приводит к эпигенетической и транскрипционной модуляции генов, связанных с эпителиально-мезенхимальным переходом. На компьютерном экране, выявленных ивермектин как перспективный кандидат в паре α-спирали домен связывания малого молекулярного веса соединения ингибировать Сида пептид, ивермектин phenocopying эффекты пептида Сида, чтобы заблокировать SIN3-парные α-спираль взаимодействия с ума, вызывая экспрессии CDH1 и ESR1, тамоксифен и восстановление чувствительности в массу медикаментов-МБ-231 и человека MMTV-усил мыши тройного негативного рака молочной железы клетки в лабораторных условиях. Добавление ивермектина привело к транскрипционной модуляции генов, связанных с эпителиально-мезенхимальным переходом, и поддержанию фенотипа раковых стволовых клеток в тройноотрицательных клетках рака молочной железы, что привело к нарушению клоногенного самообновления in vitro и ингибированию роста опухоли и метастазирования in vivo.112Сообщалось, что ивермектин индуцирует гиперполяризацию мембран, зависящую от хлорида, и гибель клеток в лейкозных клетках, а также было высказано предположение, что ивермектин синергизируется с химиотерапевтическими агентами цитарабином и даунорубицином для индуцирования гибели клеток в лейкозных клетках, и исследователи утверждают, что ивермектин может быть быстро внедрен в клинические испытания.113 Этот потенциал был подтвержден сообщениями о том, что ивермектин проявляет биоактивность в отношении клеток хронического лимфолейкоза и клеток рака шейки матки ME-180.114 Кроме того, было показано, что ивермектин потенцирует индуцированный доксорубицином апоптоз клеток лекарственно-устойчивого лейкоза у мышей.115 Раковые стволовые клетки являются ключевым фактором в развитии резистентности раковых клеток к химиотерапии, и эти результаты показывают, что комбинация химиотерапевтических агентов плюс ивермектин потенциально может поражать и убивать раковые стволовые клетки, что является первостепенной целью в преодолении рака.
Ивермектин подавляет пролиферацию и увеличивает апоптоз различных видов рака у человека. Избыточная экспрессия рецепторов P2X7 коррелирует с ростом опухоли и метастазированием. Однако высвобождение АТФ связано с иммуногенной гибелью раковых клеток в дополнение к воспалительным реакциям, вызванным гибелью некротических клеток. Используя ивермектин в качестве прототипа агента для аллостерической модуляции рецепторов P2X4, должно быть возможно нарушить баланс между про-выживаемостью и цитотоксическими функциями пуринергической передачи сигналов в раковых клетках. Ивермектин индуцирует аутофагию и высвобождение АТФ и HMGB1, ключевых медиаторов воспаления. Потенцированная сигнализация P2X4/P2X7 может быть дополнительно связана с богатой АТФ опухолевой средой, что объясняет избирательность модуляции пуринергических рецепторов в опухоли, подтверждая потенциал ивермектина для использования в иммунотерапии рака.116 Активация передачи сигналов WNT-TCF участвует во многих заболеваниях, включая рак легких и кишечника, но антагонисты WNT-TCF не используются в клинических условиях. Новая система скрининга обнаружила, что ивермектин ингибирует экспрессию мишеней WNT-TCF. Он подавляет уровни C-концевых β-катениновых фосфоформ и циклина D1 чувствительным к окадаиновой кислоте образом, указывая на то, что его действие включает протеинфосфатазы. В естественных условиях, ивермектин избирательно ингибирует TCF-зависимый, но не TCF-независимый рост ксенотрансплантата без побочных эффектов. Поскольку ивермектин обладает образцовыми показателями безопасности, он может быстро стать полезным инструментом в качестве блокатора ответа на пути WNT-TCF для лечения заболеваний, зависящих от WNT-TCF, включая множественные виды рака.117Исследователи недавно сообщили о прямом взаимодействии ивермектина с нематодой и тубулином человека, даже в микромолярных концентрациях. При добавлении в клетки HeLa человека ивермектин стабилизирует тубулин против деполимеризующих эффектов и предотвращает репликацию клеток in vitro, хотя торможение обратимо. Это говорит о том, что ивермектин связывается с микротрубочками млекопитающих и стабилизирует их. Таким образом, ивермектин влияет на динамику полимеризации и деполимеризации тубулина, что может привести к гибели клеток. Опять же, учитывая, что ивермектин уже одобрен для применения на людях, его быстрое развитие в качестве анти-митотического агента дает значительные перспективы.118В качестве еще одного признака растущего внимания, уделяемого ивермектину, в 2013 году китайские ученые подали заявку на международный патент "Использование ивермектина и его производных" (Номер публикации: WO/2014/059797) для новых применений в " разработке и производстве лекарственных средств для использования человеком при лечении заболеваний, связанных с метаболизмом, таких как гипергликемия, резистентность к инсулину, гипертриглицеридемия, гиперхолестеринемия, диабет, ожирение и так далее, и заболеваний, опосредованных рецепторами фамезоида X, таких как холестазия, камни в желчном пузыре, не-алкогольная жировая болезнь печени, атеросклероз, воспаление и рак’.
Источник