Как я себе это вижу
Вышла тут пару месяцев назад статья в журнале PNAS (Труды Национальной Академии Наук США, между прочим хороший журнал, полные тексты публикаций доступны он-лайн за 0 денег). Автор - Мария Бласко, одна из лучших специалистов по изучению механизмов старения. Статья важная, интересная, про теломеры, но что-то сложная. Вот я и решила нарисовать о чем речь. Позволила себе заменить некоторые термины на более простые слова. Вот что вышло.
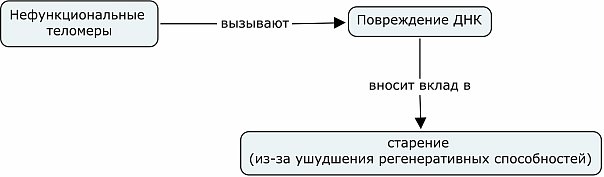
Основная мысль в общем виде.
Теперь конкретно то, что обнаружили ученые.
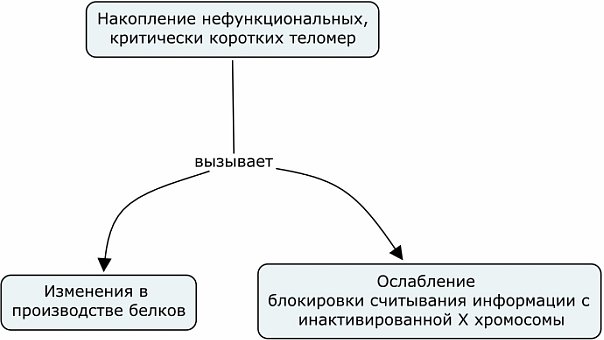
Вообще инактивация Х-хромосомы нужна для того, чтобы у женских особей не получалось вдвое больше белков, чем нужно. У человека в любой соматической (то есть не половой) клетке содержится 23 пары хромосом, одна из которых половая - у женщин ХХ, у мужчин ХY, как известно. Интересно, что на Х-хромосоме более 1400 генов, а на Y - всего 86. Так вот, чтобы у женщин продукты одного и того же гена не синтезировались по 2 раза, одна из двух Х-хромосом обволакивается некодируещей РНК и превращается в "молчащий" гетерохроматин. Так вот если этот процесс нарушается, то геном становится нестабильным.
Кстати, поэтому кошки имеют 3х цветную окраску пятнами - у них ген черного и рыжего цвета шерсти один и тот же, просто это разные варианты. В некоторых местах молчит та Х-хромосома, на которой вариант гена рыжий, а в других местах - черный.
Расшифрую левую стрелочку из предыдущей картинки.
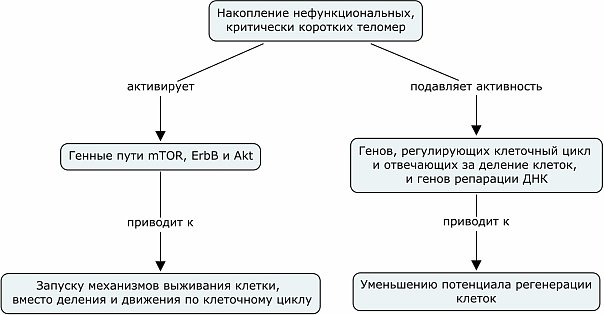
Авторы статьи называют mTOR основным интегратором стрессовых сигналов. Вообще известно, что ингибирование сигнального пути mTOR приводит к увеличению продолжительности жизни различных модельных животных. Здесь же мы видим, что активация генов из этого каскада приводит к проявлению признаков старения. Это получается из-за того, что клетка перестает двигаться по своему клеточному пути (рост, деление, рост, деление...), прекращает делится и как бы замирает. С другой стороны мы видим то, что гены репарации ДНК перестают работать так, как они должны, мутации не чинятся, в итоге ситуация ухудшается еще больше, клетки не делятся, получаем вклад в старение.
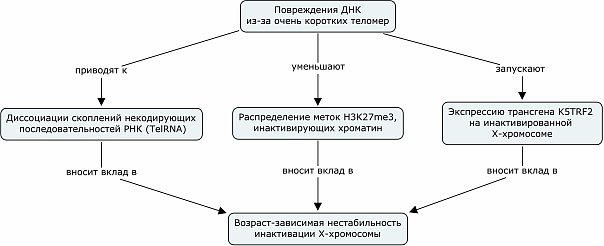
А это расшифровка правой стрелочки. Надо отметить, что мыши с активным трансгеном K5TRF2 используются авторами статьи в качестве модели ускоренного старения.
В целом, эти результаты дают основания полагать, что очень короткие теломеры активируют постоянный ответ на повреждение ДНК, который нестохастически изменяет программы экспрессии генов в сторону ареста клеточного цикла и активации путей выживания. Этот постоянный ответ на повреждение ДНК также влияет на поддержание эпигенетической памяти и организацию ядра, тем самым внося вклад в старение организма.
Основная мысль в общем виде.

Теперь конкретно то, что обнаружили ученые.

Вообще инактивация Х-хромосомы нужна для того, чтобы у женских особей не получалось вдвое больше белков, чем нужно. У человека в любой соматической (то есть не половой) клетке содержится 23 пары хромосом, одна из которых половая - у женщин ХХ, у мужчин ХY, как известно. Интересно, что на Х-хромосоме более 1400 генов, а на Y - всего 86. Так вот, чтобы у женщин продукты одного и того же гена не синтезировались по 2 раза, одна из двух Х-хромосом обволакивается некодируещей РНК и превращается в "молчащий" гетерохроматин. Так вот если этот процесс нарушается, то геном становится нестабильным.
Кстати, поэтому кошки имеют 3х цветную окраску пятнами - у них ген черного и рыжего цвета шерсти один и тот же, просто это разные варианты. В некоторых местах молчит та Х-хромосома, на которой вариант гена рыжий, а в других местах - черный.
Расшифрую левую стрелочку из предыдущей картинки.

Авторы статьи называют mTOR основным интегратором стрессовых сигналов. Вообще известно, что ингибирование сигнального пути mTOR приводит к увеличению продолжительности жизни различных модельных животных. Здесь же мы видим, что активация генов из этого каскада приводит к проявлению признаков старения. Это получается из-за того, что клетка перестает двигаться по своему клеточному пути (рост, деление, рост, деление...), прекращает делится и как бы замирает. С другой стороны мы видим то, что гены репарации ДНК перестают работать так, как они должны, мутации не чинятся, в итоге ситуация ухудшается еще больше, клетки не делятся, получаем вклад в старение.

А это расшифровка правой стрелочки. Надо отметить, что мыши с активным трансгеном K5TRF2 используются авторами статьи в качестве модели ускоренного старения.
В целом, эти результаты дают основания полагать, что очень короткие теломеры активируют постоянный ответ на повреждение ДНК, который нестохастически изменяет программы экспрессии генов в сторону ареста клеточного цикла и активации путей выживания. Этот постоянный ответ на повреждение ДНК также влияет на поддержание эпигенетической памяти и организацию ядра, тем самым внося вклад в старение организма.