Внутриклеточная обратная транскрипция mPHК-v@к Pf1zer Bi0NТеch против C019
in vitro в линии клеток печени человека
Кафедра клинических наук, Лундский университет, 20502 Мальмё, Швеция
Инфекционная медицина, кафедра клинических наук, Лундский университет, 22362 Лунд, Швеция
Доклинические исследования мРНК-вакцины COVID-19 BNT162b2, разработанной Pfizer и BioNTech, показали обратимые эффекты на печень у животных, которым вводили инъекцию BNT162b2. Кроме того, недавнее исследование показало, что РНК SARS-CoV-2 может быть подвергнута обратной транскрипции и интегрирована в геном клеток человека. В этом исследовании мы исследовали влияние BNT162b2 на линию клеток печени человека Huh7 in vitro. Клетки Huh7 подвергали воздействию BNT162b2 и проводили количественную ПЦР на РНК, выделенной из клеток. Мы обнаружили высокие уровни BNT162b2 в клетках Huh7 и изменения в экспрессии гена длинного вкрапленного ядерного элемента-1 (LINE-1), который является эндогенной обратной транскриптазой. Иммуногистохимия с использованием связывания антител с РНК-связывающим белком открытой рамки считывания-1 LINE-1 (ORFp1) на клетках Huh7, обработанных BNT162b2, показала повышенное распределение ядра LINE-1. ПЦР на геномной ДНК клеток Huh7, подвергнутых воздействию BNT162b2, амплифицирует последовательность ДНК, уникальную для BNT162b2. Наши результаты указывают на быстрое поглощение BNT162b2 линией клеток печени человека Huh7, что приводит к изменениям в экспрессии и распределении LINE-1. Мы также показываем, что мРНК BNT162b2 обратно транскрибируется внутриклеточно в ДНК уже через 6 часов после воздействия BNT162b2.
Недавнее исследование показало, что РНК SARS-CoV-2 могут подвергаться обратной транскрипции и интегрироваться в геном клеток человека [ 25 ]. В связи с этим возникает вопрос, может ли это происходить и с BNT162b2, который кодирует частичную РНК SARS-CoV-2. В данных по фармакокинетике, предоставленных Pfizer Европейскому агентству по лекарственным средствам (EMA), биораспределение BNT162b2 изучалось у мышей и крыс путем внутримышечной инъекции радиоактивно меченого LNP и модРНК люциферазы. Радиоактивность была обнаружена в большинстве тканей с первой временной точки (0,25 ч), и результаты показали, что место инъекции и печень были основными местами распределения с максимальными концентрациями, наблюдаемыми через 8-48 ч после введения дозы [ 26 ].]. Кроме того, у животных, которым вводили инъекцию BNT162b2, наблюдались обратимые печеночные эффекты, включая увеличение печени, вакуолизацию, повышение уровня гамма-глутамилтрансферазы (γGT) и повышение уровня аспартатаминотрансферазы (AST) и щелочной фосфатазы (ALP) [ 26 ]. Ранее сообщалось о временных печеночных эффектах, вызванных системами доставки LNP [ 27 , 28 , 29 , 30 ], тем не менее, также было показано, что пустые LNP без одной только модРНК не вызывают каких-либо значительных повреждений печени [ 27 ].]. Поэтому в этом исследовании мы стремимся изучить влияние BNT162b2 на клеточную линию печени человека in vitro и выяснить, может ли BNT162b2 быть обратно транскрибирован в ДНК с помощью эндогенных механизмов.
3. Результаты
3.1. BNT162b2 проникает в клетки Huh7 линии клеток печени человека с высокой эффективностью
Чтобы определить, проникает ли BNT162b2 в клетки печени человека, мы подвергли линию клеток печени человека Huh7 воздействию BNT162b2. В предыдущем исследовании кинетики поглощения LNP в клетках Huh7 максимальная биологическая эффективность LNP наблюдалась между 4-7 часами [ 33 ]. Поэтому в нашем исследовании клетки Huh7 культивировали с повышением концентрации BNT162b2 (0,5, 1,0 и 2,0 мкг/мл) или без него в течение 6, 24 и 48 часов. РНК экстрагировали из клеток и проводили количественную полимеразную цепную реакцию с обратной транскрипцией в реальном времени (RT-qPCR) с использованием праймеров, нацеленных на последовательность BNT162b2, как показано на фиг.1 . Полная последовательность BNT162b2 общедоступна [ 34 ].] и содержит кэп из двух нуклеотидов; 5'-нетранслируемая область (UTR), которая включает 5'-UTR гена α-глобина человека; полноразмерный S-белок SARS-CoV-2 с двумя мутациями пролина; 3'-UTR, который включает сегмент митохондриальной 12S рРНК человека (mtRNR1) и сегмент гена AES/TLE5 человека с двумя мутациями C→U; поли(А) хвост. Детальный анализ последовательности S-белка в BNT162b2 выявил 124 последовательности, которые на 100% идентичны геномным последовательностям человека, и три последовательности с несовпадением только одного нуклеотида (nt) в 19-26 nt ( Таблица S1, см. Дополнительные материалы ).). Для определения уровня РНК BNT162b2 мы разработали праймеры с прямым праймером, расположенным в областях S-белка SARS-CoV-2, и обратным праймером в 3'-UTR, что позволяет обнаруживать ПЦР-ампликон, уникальный для BNT162b2, без неспецифического связывания праймеров с геномными областями человека. .
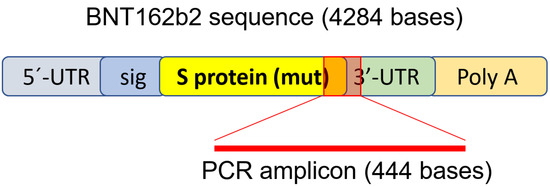
Рисунок 1. Набор праймеров для ПЦР, используемый для определения уровня мРНК и обратной транскрипции BNT162b2. Иллюстрация BNT162b2 была адаптирована из ранее описанной литературы [ 34 ].
Результаты RT-qPCR показали, что клетки Huh7, обработанные BNT162b2, имели высокие уровни мРНК BNT162b2 по сравнению с генами домашнего хозяйства через 6, 24 и 48 часов ( рис. 2 , представленные в виде логарифмических 2 -ΔΔCT из-за исключительно высоких уровней). Три концентрации BNT162b2 приводили к сходным внутриклеточным уровням мРНК BNT162b2 в разные моменты времени, за исключением того, что значительная разница между 1,0 и 2,0 мкг/мл наблюдалась через 48 часов. Уровни мРНК BNT162b2 были значительно снижены через 24 часа по сравнению с 6 часами, но снова увеличились через 48 часов.
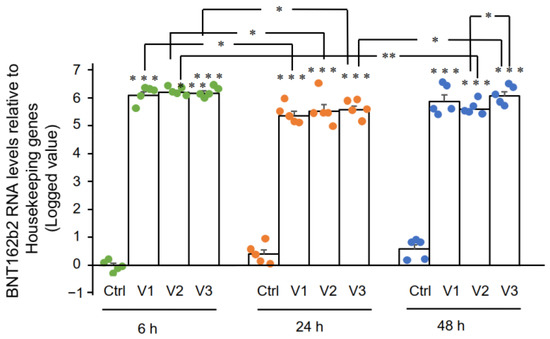
Рисунок 2. Уровни мРНК BNT162b2 в клетках Huh7, обработанных BNT162b2. Клетки Huh7 обрабатывали без (Ctrl) или 0,5 (V1), 1 (V2) и 2 мкг/мл (V3) BNT162b2 в течение 6 (зеленые точки), 24 (оранжевые точки) и 48 ч (синие точки). . РНК очищали и проводили количественную ПЦР с использованием праймеров, нацеленных на BNT162b2. Уровни РНК BNT162b2 представлены в виде логарифмических значений 2 -ΔΔCT относительно генов «домашнего хозяйства» GAPDH и ACTB . Результаты пяти независимых экспериментов ( n = 5). Различия между соответствующими группами анализировали с помощью двустороннего критерия Стьюдента . Данные выражены как среднее ± SEM. (* р < 0,05; ** р < 0,01; *** р<0,001 по сравнению с соответствующим контролем в каждый момент времени или как указано).
3.2. Влияние BNT162b2 на эндогенную обратную транскриптазу человека с длинным перемежающимся ядерным элементом-1 (LINE-1)
Здесь мы исследовали влияние BNT162b2 на экспрессию гена LINE-1 . RT-qPCR проводили на РНК, очищенной из клеток Huh7, обработанных BNT162b2 (0, 0,5, 1,0 и 2,0 мкг/мл) в течение 6, 24 и 48 часов с использованием праймеров, нацеленных на LINE-1 . Значительное увеличение экспрессии LINE-1 по сравнению с контролем наблюдалось через 6 часов при 2,0 мкг/мл BNT162b2, в то время как более низкие концентрации BNT162b2 снижали экспрессию LINE-1 во все моменты времени ( рис. 3 ).
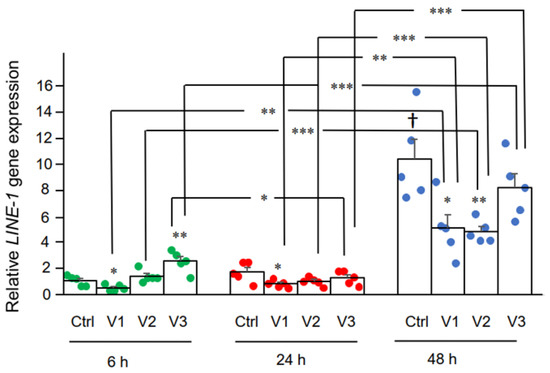
Рисунок 3. Уровни мРНК LINE-1 в клетках Huh7, обработанных BNT162b2. Клетки Huh7 обрабатывали без (Ctrl) или 0,5 (V1), 1 (V2) и 2 мкг/мл (V3) BNT162b2 в течение 6 (зеленые точки), 24 (красные точки) и 48 ч (синие точки). . РНК очищали и проводили количественную ПЦР с использованием праймеров, нацеленных на LINE-1 . Уровни РНК LINE-1 представлены как значения 2 -ΔΔCT относительно генов домашнего хозяйства GAPDH и ACTB . Результаты пяти независимых экспериментов ( n = 5). Различия между соответствующими группами анализировали с помощью двустороннего критерия Стьюдента . Данные выражены как среднее ± SEM. (* р < 0,05; ** р< 0,01; *** p < 0,001 по сравнению с соответствующим контролем в каждый момент времени или как указано; † p < 0,05 по сравнению с 6 ч-контроль).
Затем мы изучили влияние BNT162b2 на уровень белка LINE-1. Полноразмерная LINE-1 состоит из 5'-нетранслируемой области (UTR), двух открытых рамок считывания (ORF), ORF1 и ORF2, и 3'UTR, из которых ORF1 представляет собой РНК-связывающий белок с шаперонной активностью. Было показано, что ретротранспозиционная активность LINE-1 включает транслокацию ORF1 в ядро [ 35 ]. Клетки Huh7, обработанные BNT162b2 или без него (0,5, 1,0 и 2,0 мкг/мл) в течение 6 ч, фиксировали и окрашивали антителами, связывающимися с LINE-1 ORF1p, и ДНК-специфическим зондом Hoechst для визуализации клеточного ядра ( рис. 4а ). Количественная оценка интенсивности иммунофлуоресцентного окрашивания показала, что BNT162b2 повышал уровни белка ORF1p LINE-1 как во всей области клетки, так и в ядре при всех протестированных концентрациях (Рисунок 4 б-г).
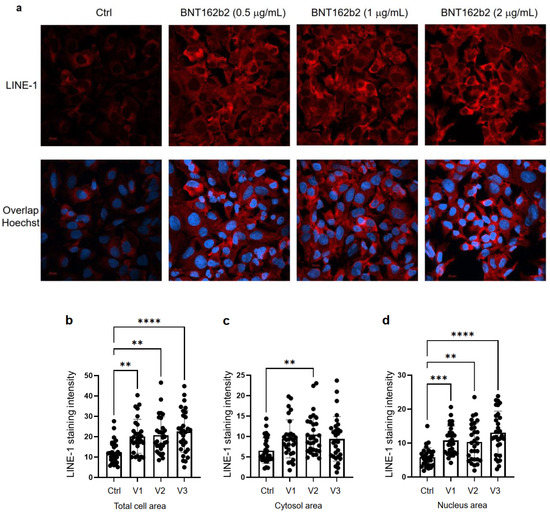
Рисунок 4. Иммуногистохимия клеток Huh7, обработанных BNT162b2, по распределению белка LINE-1. Клетки Huh7 обрабатывали без (Ctrl) или 0,5, 1 и 2 мкг/мл BNT162b2 в течение 6 часов. Клетки фиксировали и окрашивали антителами, связывающимися с ORF1p LINE-1 (красный) и ДНК-специфическим зондом Hoechst для визуализации клеточного ядра (синий). ( а ) Репрезентативные изображения экспрессии LINE-1 в клетках Huh7, обработанных BNT162b2 или без него. ( б - г ) Количественное определение белка LINE-1 в области всей клетки ( б ), цитозоле ( в ) и ядре ( г ). Все данные были проанализированы с использованием однофакторного дисперсионного анализа, а графики были созданы с использованием GraphPad Prism V 9.2. Все данные представлены как среднее значение ± стандартное отклонение (** p< 0,01; *** р < 0,001; **** p <0,0001, как указано).
3.3. Обнаружение ДНК BNT162b2 с обратной транскрипцией в клетках Huh7
Предыдущее исследование показало, что проникновение белка LINE-1 в ядро связано с ретротранспозицией [ 35 ]. В описанном выше эксперименте с иммунофлуоресцентным окрашиванием повышенные уровни LINE-1 в ядре наблюдались уже при самой низкой концентрации BNT162b2 (0,5 мкг/мл). Чтобы проверить, транскрибируется ли BNT162b2 обратно в ДНК при повышении уровня LINE-1, мы очистили геномную ДНК из клеток Huh7, обработанных 0,5 мкг/мл BNT162b2 в течение 6, 24 и 48 часов. Очищенную ДНК обрабатывали РНКазой для удаления РНК и подвергали ПЦР с использованием праймеров, нацеленных на BNT162b2, как показано на фиг.1 . Затем амплифицированные фрагменты ДНК визуализировали с помощью электрофореза и очищали в геле ( рис. 5 ).). Ампликоны ДНК BNT162b2 были обнаружены во всех трех временных точках (6, 24 и 48 ч). Секвенирование по Сэнгеру подтвердило, что ампликоны ДНК были идентичны последовательности BNT162b2, окруженной праймерами ( таблица 2 ). Чтобы убедиться, что ампликоны ДНК были получены из ДНК, а не из РНК BNT162b2, мы также провели ПЦР на РНК, очищенной из клеток Huh7, обработанных 0,5 мкг/мл BNT162b2 в течение 6 часов, с обработкой РНКазой или без нее (Ctrl 5 и 6 на рисунке 5 ) . , а в образцах РНК, подвергнутых ПЦР, ампликон не обнаружен.
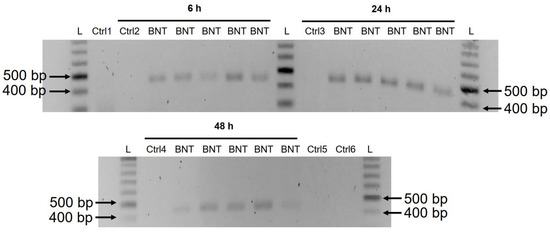
Рисунок 5. Обнаружение ампликонов ДНК BNT162b2 в клетках Huh7, обработанных BNT162b2. Клетки Huh7 обрабатывали без (Ctrl) или 0,5 мкг/мл BNT162b2 в течение 6, 24 и 48 часов. Геномную ДНК очищали и расщепляли 100 мкг/мл РНКазы. ПЦР проводили на всех образцах с праймерами, нацеленными на BNT162b2, как показано на рисунке 1 и в таблице 1 .. Ампликоны ДНК (444 п.н.) визуализировали на агарозном геле. БНТ: BNT162b2; L: лестница ДНК; Ctrl1: культивированные клетки Huh7; Ctrl2: клетки Huh7 без обработки BNT162b2, собранные через 6 часов; Ctrl3: клетки Huh7 без обработки BNT162b2, собранные через 24 часа; Ctrl4: клетки Huh7 без обработки BNT162b2, собранные через 48 часов; Ctrl5: РНК из клеток Huh7, обработанных 0,5 мкг/мл BNT162b2 в течение 6 ч; Ctrl6: РНК из клеток Huh7, обработанных 0,5 мкг/мл BNT162b2 в течение 6 ч, расщепленных РНКазой.
Таблица 2. Результат секвенирования по Сэнгеру ампликона BNT162b2.

4. Обсуждение
В этом исследовании мы представляем доказательства того, что мРНК-вакцина COVID-19 BNT162b2 способна проникать в клеточную линию Huh7 печени человека in vitro. мРНК BNT162b2 обратно транскрибируется внутриклеточно в ДНК уже через 6 часов после воздействия BNT162b2. Возможным механизмом обратной транскрипции является эндогенная обратная транскриптаза LINE-1, а распределение белков ядра LINE-1 повышается с помощью BNT162b2.Внутриклеточное накопление LNP в гепатоцитах было продемонстрировано in vivo [ 36 ]. Доклиническое исследование BNT162b2 показало, что BNT162b2 проникает в клетки линии клеток человека HEK293T и приводит к сильной экспрессии антигена BNT162b2 [ 37 ]. Поэтому в этом исследовании мы сначала исследовали проникновение BNT162b2 в клетки линии клеток печени человека Huh7. Выбор концентраций BNT162b2, используемых в этом исследовании, требует объяснения. BNT162b2 вводят в виде серии из двух доз с интервалом в три недели, и каждая доза содержит 30 мкг BNT162b2 в объеме 0,3 мл, что обеспечивает максимальную локальную концентрацию в месте инъекции 100 мкг/мл [ 31 ].]. Предыдущее исследование мРНК-вакцин против вирусов гриппа H10N8 и H7N9 с использованием аналогичной системы доставки LNP показало, что мРНК-вакцина может довольно неспецифически распределяться в несколько органов, таких как печень, селезенка, сердце, почки, легкие и мозг, а концентрация в печени примерно в 100 раз ниже, чем в месте внутримышечной инъекции [ 38 ]. В отчете об оценке BNT162b2, предоставленном EMA компанией Pfizer, исследования фармакокинетического распределения у крыс показали, что относительно большая часть (до 18%) общей дозы распределяется в печени [ 26 ].]. Поэтому мы решили использовать 0,5, 1 и 2 мкг/мл вакцины в наших экспериментах на клетках печени. Однако влияние более широкого диапазона более низких и более высоких концентраций BNT162b2 также следует проверить в будущих исследованиях.В текущем исследовании мы использовали линию клеток печени человека для исследования in vitro. Стоит выяснить, представляют ли клетки печени также спайковый белок SARS-CoV-2, полученный из вакцины, который потенциально может сделать клетки печени мишенями для ранее примированных цитотоксических Т-клеток, реагирующих с спайковым белком. Имеются сообщения о случаях у лиц, у которых развился аутоиммунный гепатит [ 39 ] после вакцинации BNT162b2. Чтобы лучше понять потенциальное влияние BNT162b2 на функцию печени, для будущих исследований желательны модели in vivo.В отчете о токсичности BNT162b2 не было представлено ни исследований генотоксичности, ни канцерогенности [ 26 ]. Наше исследование показывает, что BNT162b2 может быть обратно транскрибирован в ДНК в клеточной линии печени Huh7, и это может вызвать опасения, что ДНК, полученная из BNT162b2, может быть интегрирована в геном хозяина и влиять на целостность геномной ДНК, что может потенциально опосредовать генотоксичность. побочные эффекты. На данном этапе мы не знаем, интегрируется ли ДНК, обратно транскрибированная из BNT162b2, в геном клетки. Необходимы дальнейшие исследования, чтобы продемонстрировать влияние BNT162b2 на целостность генома, включая полногеномное секвенирование клеток, подвергшихся воздействию BNT162b2, а также тканей людей, получивших вакцинацию BNT162b2.Автономный ретротранспозон человека LINE-1 представляет собой клеточную эндогенную обратную транскриптазу и единственный оставшийся активный транспозон у людей, способный ретротранспонировать себя и другие неавтономные элементы [ 40 , 41 ], и примерно 17% генома человека состоит из последовательностей LINE-1. [ 42 ]. Неавтономные элементы Alu , короткие вкрапленные нуклеотидные элементы (SINE), переменное число тандемных повторов (VNTR), а также псевдогены, процессированные клеточной мРНК, ретротранспонируются ретротранспозиционными белками LINE-1, работающими в транс [ 43 ]. , 44]. Недавнее исследование показало, что эндогенный LINE-1 опосредует обратную транскрипцию и интеграцию последовательностей SARS-CoV-2 в геномы инфицированных клеток человека [ 25 ]. Кроме того, экспрессия эндогенного LINE-1 часто увеличивается при вирусной инфекции, включая инфекцию SARS-CoV-2 [ 45 , 46 , 47 ]. Предыдущие исследования показали, что ретротранспозиционная активность LINE-1 регулируется метаболизмом РНК [ 48 , 49 ], реакцией на повреждение ДНК [ 50 ] и аутофагией [ 51 ]. Эффективная ретротранспозиция LINE-1 часто связана с разрушением клеточного цикла и ядерной оболочки во время митоза [ 52 , 53 ].], а также экзогенные ретровирусы [ 54 , 55 ], что способствует проникновению LINE-1 в ядро. В нашем исследовании мы наблюдали повышенное распределение ORF1p LINE-1, определенное с помощью иммуногистохимии, в ядре с помощью BNT162b2 при всех испытанных концентрациях (0,5, 1 и 2 мкг/мл), в то время как повышенное LINE-1экспрессия гена была обнаружена при самой высокой концентрации BNT162b2 (2 мкг/мл). Стоит отметить, что транскрипция генов регулируется модификациями хроматина, регуляцией факторов транскрипции и скоростью деградации РНК, в то время как трансляционная регуляция белка включает рекрутирование рибосом на инициирующий кодон, модуляцию удлинения пептида, терминацию синтеза белка или биогенез рибосом. . Эти два процесса контролируются разными механизмами, и поэтому они не всегда могут демонстрировать одинаковые модели изменений в ответ на внешние вызовы. Точная регуляция активности LINE-1 в ответ на BNT162b2 заслуживает дальнейшего изучения.Клеточная модель, которую мы использовали в этом исследовании, представляет собой клеточную линию карциномы с активной репликацией ДНК, которая отличается от неделящихся соматических клеток. Также было показано, что клетки Huh7 обнаруживают существенно различную экспрессию генов и белков, включая повышенную экспрессию белков, участвующих в метаболизме РНК [ 56 ]. Однако пролиферация клеток также активна в некоторых тканях человека, таких как костный мозг или базальные слои эпителия, а также во время эмбриогенеза, поэтому необходимо изучить влияние BNT162b2 на целостность генома в таких условиях. Более того, об эффективной ретротранспозиции LINE-1 также сообщалось в неделящихся и терминально дифференцированных клетках, таких как нейроны человека [ 57 , 58 ].Оценочный отчет Pfizer EMA также показал, что BNT162b2 распределяется в селезенке (<1,1%), надпочечниках (<0,1%), а также имеет низкую и измеримую радиоактивность в яичниках и яичках (<0,1%). 26 ]. Кроме того, в оценочном отчете Pfizer EMA отсутствуют данные о плацентарном переносе BNT162b2. Наши результаты показали, что мРНК BNT162b2 легко проникает в клетки Huh7 в концентрации (0,5 мкг/мл), соответствующей 0,5% локальной концентрации в месте инъекции, вызывает изменения в экспрессии гена LINE-1 и белка, а в течение 6 ч - обратную транскрипцию BNT162b2. может быть обнаружен. Поэтому важно дополнительно исследовать влияние BNT162b2 на другие типы клеток и тканей как in vitro, так и in vivo.
5. Выводы
Наше исследование является первым исследованием in vitro воздействия мРНК-вакцины COVID-19 BNT162b2 на клеточную линию печени человека. Мы приводим доказательства быстрого проникновения BNT162b2 в клетки и последующей внутриклеточной обратной транскрипции мРНК BNT162b2 в ДНК.
https://www.mdpi.com/1467-3045/44/3/73/htm
Кафедра клинических наук, Лундский университет, 20502 Мальмё, Швеция
Инфекционная медицина, кафедра клинических наук, Лундский университет, 22362 Лунд, Швеция
Доклинические исследования мРНК-вакцины COVID-19 BNT162b2, разработанной Pfizer и BioNTech, показали обратимые эффекты на печень у животных, которым вводили инъекцию BNT162b2. Кроме того, недавнее исследование показало, что РНК SARS-CoV-2 может быть подвергнута обратной транскрипции и интегрирована в геном клеток человека. В этом исследовании мы исследовали влияние BNT162b2 на линию клеток печени человека Huh7 in vitro. Клетки Huh7 подвергали воздействию BNT162b2 и проводили количественную ПЦР на РНК, выделенной из клеток. Мы обнаружили высокие уровни BNT162b2 в клетках Huh7 и изменения в экспрессии гена длинного вкрапленного ядерного элемента-1 (LINE-1), который является эндогенной обратной транскриптазой. Иммуногистохимия с использованием связывания антител с РНК-связывающим белком открытой рамки считывания-1 LINE-1 (ORFp1) на клетках Huh7, обработанных BNT162b2, показала повышенное распределение ядра LINE-1. ПЦР на геномной ДНК клеток Huh7, подвергнутых воздействию BNT162b2, амплифицирует последовательность ДНК, уникальную для BNT162b2. Наши результаты указывают на быстрое поглощение BNT162b2 линией клеток печени человека Huh7, что приводит к изменениям в экспрессии и распределении LINE-1. Мы также показываем, что мРНК BNT162b2 обратно транскрибируется внутриклеточно в ДНК уже через 6 часов после воздействия BNT162b2.
Недавнее исследование показало, что РНК SARS-CoV-2 могут подвергаться обратной транскрипции и интегрироваться в геном клеток человека [ 25 ]. В связи с этим возникает вопрос, может ли это происходить и с BNT162b2, который кодирует частичную РНК SARS-CoV-2. В данных по фармакокинетике, предоставленных Pfizer Европейскому агентству по лекарственным средствам (EMA), биораспределение BNT162b2 изучалось у мышей и крыс путем внутримышечной инъекции радиоактивно меченого LNP и модРНК люциферазы. Радиоактивность была обнаружена в большинстве тканей с первой временной точки (0,25 ч), и результаты показали, что место инъекции и печень были основными местами распределения с максимальными концентрациями, наблюдаемыми через 8-48 ч после введения дозы [ 26 ].]. Кроме того, у животных, которым вводили инъекцию BNT162b2, наблюдались обратимые печеночные эффекты, включая увеличение печени, вакуолизацию, повышение уровня гамма-глутамилтрансферазы (γGT) и повышение уровня аспартатаминотрансферазы (AST) и щелочной фосфатазы (ALP) [ 26 ]. Ранее сообщалось о временных печеночных эффектах, вызванных системами доставки LNP [ 27 , 28 , 29 , 30 ], тем не менее, также было показано, что пустые LNP без одной только модРНК не вызывают каких-либо значительных повреждений печени [ 27 ].]. Поэтому в этом исследовании мы стремимся изучить влияние BNT162b2 на клеточную линию печени человека in vitro и выяснить, может ли BNT162b2 быть обратно транскрибирован в ДНК с помощью эндогенных механизмов.
3. Результаты
3.1. BNT162b2 проникает в клетки Huh7 линии клеток печени человека с высокой эффективностью
Чтобы определить, проникает ли BNT162b2 в клетки печени человека, мы подвергли линию клеток печени человека Huh7 воздействию BNT162b2. В предыдущем исследовании кинетики поглощения LNP в клетках Huh7 максимальная биологическая эффективность LNP наблюдалась между 4-7 часами [ 33 ]. Поэтому в нашем исследовании клетки Huh7 культивировали с повышением концентрации BNT162b2 (0,5, 1,0 и 2,0 мкг/мл) или без него в течение 6, 24 и 48 часов. РНК экстрагировали из клеток и проводили количественную полимеразную цепную реакцию с обратной транскрипцией в реальном времени (RT-qPCR) с использованием праймеров, нацеленных на последовательность BNT162b2, как показано на фиг.1 . Полная последовательность BNT162b2 общедоступна [ 34 ].] и содержит кэп из двух нуклеотидов; 5'-нетранслируемая область (UTR), которая включает 5'-UTR гена α-глобина человека; полноразмерный S-белок SARS-CoV-2 с двумя мутациями пролина; 3'-UTR, который включает сегмент митохондриальной 12S рРНК человека (mtRNR1) и сегмент гена AES/TLE5 человека с двумя мутациями C→U; поли(А) хвост. Детальный анализ последовательности S-белка в BNT162b2 выявил 124 последовательности, которые на 100% идентичны геномным последовательностям человека, и три последовательности с несовпадением только одного нуклеотида (nt) в 19-26 nt ( Таблица S1, см. Дополнительные материалы ).). Для определения уровня РНК BNT162b2 мы разработали праймеры с прямым праймером, расположенным в областях S-белка SARS-CoV-2, и обратным праймером в 3'-UTR, что позволяет обнаруживать ПЦР-ампликон, уникальный для BNT162b2, без неспецифического связывания праймеров с геномными областями человека. .

Рисунок 1. Набор праймеров для ПЦР, используемый для определения уровня мРНК и обратной транскрипции BNT162b2. Иллюстрация BNT162b2 была адаптирована из ранее описанной литературы [ 34 ].
Результаты RT-qPCR показали, что клетки Huh7, обработанные BNT162b2, имели высокие уровни мРНК BNT162b2 по сравнению с генами домашнего хозяйства через 6, 24 и 48 часов ( рис. 2 , представленные в виде логарифмических 2 -ΔΔCT из-за исключительно высоких уровней). Три концентрации BNT162b2 приводили к сходным внутриклеточным уровням мРНК BNT162b2 в разные моменты времени, за исключением того, что значительная разница между 1,0 и 2,0 мкг/мл наблюдалась через 48 часов. Уровни мРНК BNT162b2 были значительно снижены через 24 часа по сравнению с 6 часами, но снова увеличились через 48 часов.

Рисунок 2. Уровни мРНК BNT162b2 в клетках Huh7, обработанных BNT162b2. Клетки Huh7 обрабатывали без (Ctrl) или 0,5 (V1), 1 (V2) и 2 мкг/мл (V3) BNT162b2 в течение 6 (зеленые точки), 24 (оранжевые точки) и 48 ч (синие точки). . РНК очищали и проводили количественную ПЦР с использованием праймеров, нацеленных на BNT162b2. Уровни РНК BNT162b2 представлены в виде логарифмических значений 2 -ΔΔCT относительно генов «домашнего хозяйства» GAPDH и ACTB . Результаты пяти независимых экспериментов ( n = 5). Различия между соответствующими группами анализировали с помощью двустороннего критерия Стьюдента . Данные выражены как среднее ± SEM. (* р < 0,05; ** р < 0,01; *** р<0,001 по сравнению с соответствующим контролем в каждый момент времени или как указано).
3.2. Влияние BNT162b2 на эндогенную обратную транскриптазу человека с длинным перемежающимся ядерным элементом-1 (LINE-1)
Здесь мы исследовали влияние BNT162b2 на экспрессию гена LINE-1 . RT-qPCR проводили на РНК, очищенной из клеток Huh7, обработанных BNT162b2 (0, 0,5, 1,0 и 2,0 мкг/мл) в течение 6, 24 и 48 часов с использованием праймеров, нацеленных на LINE-1 . Значительное увеличение экспрессии LINE-1 по сравнению с контролем наблюдалось через 6 часов при 2,0 мкг/мл BNT162b2, в то время как более низкие концентрации BNT162b2 снижали экспрессию LINE-1 во все моменты времени ( рис. 3 ).

Рисунок 3. Уровни мРНК LINE-1 в клетках Huh7, обработанных BNT162b2. Клетки Huh7 обрабатывали без (Ctrl) или 0,5 (V1), 1 (V2) и 2 мкг/мл (V3) BNT162b2 в течение 6 (зеленые точки), 24 (красные точки) и 48 ч (синие точки). . РНК очищали и проводили количественную ПЦР с использованием праймеров, нацеленных на LINE-1 . Уровни РНК LINE-1 представлены как значения 2 -ΔΔCT относительно генов домашнего хозяйства GAPDH и ACTB . Результаты пяти независимых экспериментов ( n = 5). Различия между соответствующими группами анализировали с помощью двустороннего критерия Стьюдента . Данные выражены как среднее ± SEM. (* р < 0,05; ** р< 0,01; *** p < 0,001 по сравнению с соответствующим контролем в каждый момент времени или как указано; † p < 0,05 по сравнению с 6 ч-контроль).
Затем мы изучили влияние BNT162b2 на уровень белка LINE-1. Полноразмерная LINE-1 состоит из 5'-нетранслируемой области (UTR), двух открытых рамок считывания (ORF), ORF1 и ORF2, и 3'UTR, из которых ORF1 представляет собой РНК-связывающий белок с шаперонной активностью. Было показано, что ретротранспозиционная активность LINE-1 включает транслокацию ORF1 в ядро [ 35 ]. Клетки Huh7, обработанные BNT162b2 или без него (0,5, 1,0 и 2,0 мкг/мл) в течение 6 ч, фиксировали и окрашивали антителами, связывающимися с LINE-1 ORF1p, и ДНК-специфическим зондом Hoechst для визуализации клеточного ядра ( рис. 4а ). Количественная оценка интенсивности иммунофлуоресцентного окрашивания показала, что BNT162b2 повышал уровни белка ORF1p LINE-1 как во всей области клетки, так и в ядре при всех протестированных концентрациях (Рисунок 4 б-г).

Рисунок 4. Иммуногистохимия клеток Huh7, обработанных BNT162b2, по распределению белка LINE-1. Клетки Huh7 обрабатывали без (Ctrl) или 0,5, 1 и 2 мкг/мл BNT162b2 в течение 6 часов. Клетки фиксировали и окрашивали антителами, связывающимися с ORF1p LINE-1 (красный) и ДНК-специфическим зондом Hoechst для визуализации клеточного ядра (синий). ( а ) Репрезентативные изображения экспрессии LINE-1 в клетках Huh7, обработанных BNT162b2 или без него. ( б - г ) Количественное определение белка LINE-1 в области всей клетки ( б ), цитозоле ( в ) и ядре ( г ). Все данные были проанализированы с использованием однофакторного дисперсионного анализа, а графики были созданы с использованием GraphPad Prism V 9.2. Все данные представлены как среднее значение ± стандартное отклонение (** p< 0,01; *** р < 0,001; **** p <0,0001, как указано).
3.3. Обнаружение ДНК BNT162b2 с обратной транскрипцией в клетках Huh7
Предыдущее исследование показало, что проникновение белка LINE-1 в ядро связано с ретротранспозицией [ 35 ]. В описанном выше эксперименте с иммунофлуоресцентным окрашиванием повышенные уровни LINE-1 в ядре наблюдались уже при самой низкой концентрации BNT162b2 (0,5 мкг/мл). Чтобы проверить, транскрибируется ли BNT162b2 обратно в ДНК при повышении уровня LINE-1, мы очистили геномную ДНК из клеток Huh7, обработанных 0,5 мкг/мл BNT162b2 в течение 6, 24 и 48 часов. Очищенную ДНК обрабатывали РНКазой для удаления РНК и подвергали ПЦР с использованием праймеров, нацеленных на BNT162b2, как показано на фиг.1 . Затем амплифицированные фрагменты ДНК визуализировали с помощью электрофореза и очищали в геле ( рис. 5 ).). Ампликоны ДНК BNT162b2 были обнаружены во всех трех временных точках (6, 24 и 48 ч). Секвенирование по Сэнгеру подтвердило, что ампликоны ДНК были идентичны последовательности BNT162b2, окруженной праймерами ( таблица 2 ). Чтобы убедиться, что ампликоны ДНК были получены из ДНК, а не из РНК BNT162b2, мы также провели ПЦР на РНК, очищенной из клеток Huh7, обработанных 0,5 мкг/мл BNT162b2 в течение 6 часов, с обработкой РНКазой или без нее (Ctrl 5 и 6 на рисунке 5 ) . , а в образцах РНК, подвергнутых ПЦР, ампликон не обнаружен.

Рисунок 5. Обнаружение ампликонов ДНК BNT162b2 в клетках Huh7, обработанных BNT162b2. Клетки Huh7 обрабатывали без (Ctrl) или 0,5 мкг/мл BNT162b2 в течение 6, 24 и 48 часов. Геномную ДНК очищали и расщепляли 100 мкг/мл РНКазы. ПЦР проводили на всех образцах с праймерами, нацеленными на BNT162b2, как показано на рисунке 1 и в таблице 1 .. Ампликоны ДНК (444 п.н.) визуализировали на агарозном геле. БНТ: BNT162b2; L: лестница ДНК; Ctrl1: культивированные клетки Huh7; Ctrl2: клетки Huh7 без обработки BNT162b2, собранные через 6 часов; Ctrl3: клетки Huh7 без обработки BNT162b2, собранные через 24 часа; Ctrl4: клетки Huh7 без обработки BNT162b2, собранные через 48 часов; Ctrl5: РНК из клеток Huh7, обработанных 0,5 мкг/мл BNT162b2 в течение 6 ч; Ctrl6: РНК из клеток Huh7, обработанных 0,5 мкг/мл BNT162b2 в течение 6 ч, расщепленных РНКазой.
Таблица 2. Результат секвенирования по Сэнгеру ампликона BNT162b2.

4. Обсуждение
В этом исследовании мы представляем доказательства того, что мРНК-вакцина COVID-19 BNT162b2 способна проникать в клеточную линию Huh7 печени человека in vitro. мРНК BNT162b2 обратно транскрибируется внутриклеточно в ДНК уже через 6 часов после воздействия BNT162b2. Возможным механизмом обратной транскрипции является эндогенная обратная транскриптаза LINE-1, а распределение белков ядра LINE-1 повышается с помощью BNT162b2.Внутриклеточное накопление LNP в гепатоцитах было продемонстрировано in vivo [ 36 ]. Доклиническое исследование BNT162b2 показало, что BNT162b2 проникает в клетки линии клеток человека HEK293T и приводит к сильной экспрессии антигена BNT162b2 [ 37 ]. Поэтому в этом исследовании мы сначала исследовали проникновение BNT162b2 в клетки линии клеток печени человека Huh7. Выбор концентраций BNT162b2, используемых в этом исследовании, требует объяснения. BNT162b2 вводят в виде серии из двух доз с интервалом в три недели, и каждая доза содержит 30 мкг BNT162b2 в объеме 0,3 мл, что обеспечивает максимальную локальную концентрацию в месте инъекции 100 мкг/мл [ 31 ].]. Предыдущее исследование мРНК-вакцин против вирусов гриппа H10N8 и H7N9 с использованием аналогичной системы доставки LNP показало, что мРНК-вакцина может довольно неспецифически распределяться в несколько органов, таких как печень, селезенка, сердце, почки, легкие и мозг, а концентрация в печени примерно в 100 раз ниже, чем в месте внутримышечной инъекции [ 38 ]. В отчете об оценке BNT162b2, предоставленном EMA компанией Pfizer, исследования фармакокинетического распределения у крыс показали, что относительно большая часть (до 18%) общей дозы распределяется в печени [ 26 ].]. Поэтому мы решили использовать 0,5, 1 и 2 мкг/мл вакцины в наших экспериментах на клетках печени. Однако влияние более широкого диапазона более низких и более высоких концентраций BNT162b2 также следует проверить в будущих исследованиях.В текущем исследовании мы использовали линию клеток печени человека для исследования in vitro. Стоит выяснить, представляют ли клетки печени также спайковый белок SARS-CoV-2, полученный из вакцины, который потенциально может сделать клетки печени мишенями для ранее примированных цитотоксических Т-клеток, реагирующих с спайковым белком. Имеются сообщения о случаях у лиц, у которых развился аутоиммунный гепатит [ 39 ] после вакцинации BNT162b2. Чтобы лучше понять потенциальное влияние BNT162b2 на функцию печени, для будущих исследований желательны модели in vivo.В отчете о токсичности BNT162b2 не было представлено ни исследований генотоксичности, ни канцерогенности [ 26 ]. Наше исследование показывает, что BNT162b2 может быть обратно транскрибирован в ДНК в клеточной линии печени Huh7, и это может вызвать опасения, что ДНК, полученная из BNT162b2, может быть интегрирована в геном хозяина и влиять на целостность геномной ДНК, что может потенциально опосредовать генотоксичность. побочные эффекты. На данном этапе мы не знаем, интегрируется ли ДНК, обратно транскрибированная из BNT162b2, в геном клетки. Необходимы дальнейшие исследования, чтобы продемонстрировать влияние BNT162b2 на целостность генома, включая полногеномное секвенирование клеток, подвергшихся воздействию BNT162b2, а также тканей людей, получивших вакцинацию BNT162b2.Автономный ретротранспозон человека LINE-1 представляет собой клеточную эндогенную обратную транскриптазу и единственный оставшийся активный транспозон у людей, способный ретротранспонировать себя и другие неавтономные элементы [ 40 , 41 ], и примерно 17% генома человека состоит из последовательностей LINE-1. [ 42 ]. Неавтономные элементы Alu , короткие вкрапленные нуклеотидные элементы (SINE), переменное число тандемных повторов (VNTR), а также псевдогены, процессированные клеточной мРНК, ретротранспонируются ретротранспозиционными белками LINE-1, работающими в транс [ 43 ]. , 44]. Недавнее исследование показало, что эндогенный LINE-1 опосредует обратную транскрипцию и интеграцию последовательностей SARS-CoV-2 в геномы инфицированных клеток человека [ 25 ]. Кроме того, экспрессия эндогенного LINE-1 часто увеличивается при вирусной инфекции, включая инфекцию SARS-CoV-2 [ 45 , 46 , 47 ]. Предыдущие исследования показали, что ретротранспозиционная активность LINE-1 регулируется метаболизмом РНК [ 48 , 49 ], реакцией на повреждение ДНК [ 50 ] и аутофагией [ 51 ]. Эффективная ретротранспозиция LINE-1 часто связана с разрушением клеточного цикла и ядерной оболочки во время митоза [ 52 , 53 ].], а также экзогенные ретровирусы [ 54 , 55 ], что способствует проникновению LINE-1 в ядро. В нашем исследовании мы наблюдали повышенное распределение ORF1p LINE-1, определенное с помощью иммуногистохимии, в ядре с помощью BNT162b2 при всех испытанных концентрациях (0,5, 1 и 2 мкг/мл), в то время как повышенное LINE-1экспрессия гена была обнаружена при самой высокой концентрации BNT162b2 (2 мкг/мл). Стоит отметить, что транскрипция генов регулируется модификациями хроматина, регуляцией факторов транскрипции и скоростью деградации РНК, в то время как трансляционная регуляция белка включает рекрутирование рибосом на инициирующий кодон, модуляцию удлинения пептида, терминацию синтеза белка или биогенез рибосом. . Эти два процесса контролируются разными механизмами, и поэтому они не всегда могут демонстрировать одинаковые модели изменений в ответ на внешние вызовы. Точная регуляция активности LINE-1 в ответ на BNT162b2 заслуживает дальнейшего изучения.Клеточная модель, которую мы использовали в этом исследовании, представляет собой клеточную линию карциномы с активной репликацией ДНК, которая отличается от неделящихся соматических клеток. Также было показано, что клетки Huh7 обнаруживают существенно различную экспрессию генов и белков, включая повышенную экспрессию белков, участвующих в метаболизме РНК [ 56 ]. Однако пролиферация клеток также активна в некоторых тканях человека, таких как костный мозг или базальные слои эпителия, а также во время эмбриогенеза, поэтому необходимо изучить влияние BNT162b2 на целостность генома в таких условиях. Более того, об эффективной ретротранспозиции LINE-1 также сообщалось в неделящихся и терминально дифференцированных клетках, таких как нейроны человека [ 57 , 58 ].Оценочный отчет Pfizer EMA также показал, что BNT162b2 распределяется в селезенке (<1,1%), надпочечниках (<0,1%), а также имеет низкую и измеримую радиоактивность в яичниках и яичках (<0,1%). 26 ]. Кроме того, в оценочном отчете Pfizer EMA отсутствуют данные о плацентарном переносе BNT162b2. Наши результаты показали, что мРНК BNT162b2 легко проникает в клетки Huh7 в концентрации (0,5 мкг/мл), соответствующей 0,5% локальной концентрации в месте инъекции, вызывает изменения в экспрессии гена LINE-1 и белка, а в течение 6 ч - обратную транскрипцию BNT162b2. может быть обнаружен. Поэтому важно дополнительно исследовать влияние BNT162b2 на другие типы клеток и тканей как in vitro, так и in vivo.
5. Выводы
Наше исследование является первым исследованием in vitro воздействия мРНК-вакцины COVID-19 BNT162b2 на клеточную линию печени человека. Мы приводим доказательства быстрого проникновения BNT162b2 в клетки и последующей внутриклеточной обратной транскрипции мРНК BNT162b2 в ДНК.
https://www.mdpi.com/1467-3045/44/3/73/htm