В США всё же одобрили противораковый препарат «последней надежды»

По принципу действия новый препарат "последней надежды" отличается от других противораковых средств, а потому может помочь там, где другие виды терапии не спасают. Фото Global Look Press.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) сообщило об ускоренном одобрении нового лекарства от рака. Речь идёт о препарате селинексор (selinexor), который выпускается под торговым названием Xpovio. Он предназначен для лечения множественной миеломы.
Недуг этот также известен как миеломная болезнь. Это заболевание системы крови. В этом случае злокачественная опухоль из плазматических клеток локализована преимущественно в костном мозге (напомним, что именно он отвечает за производство новых клеток крови).
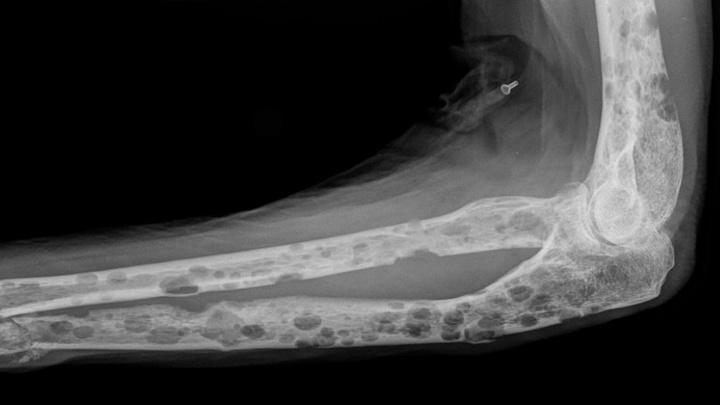
Рентгенограмма, демонстрирующая множественные очаги деструкции в костях, обусловленные миеломной болезнью. Патологический перелом локтевой кости. Фото Hellerhoff/Wikimedia Commons.
Авторы разработки из Онкологического центра Абрамсона в Университете Пенсильвании поясняют, что по принципу действия селинексор отличается от других противораковых препаратов. Он является селективным ингибитором ядерного экспорта: проникает в клетку и воздействует на механизмы, которые отвечают за транспортировку определённых молекул внутрь клетки и из неё.
Дело в том, что раковым клеткам необходимо экспортировать из ядер белок под названием XPO1. Последний подавляет рост опухоли, а стало быть, блокировка этого процесса облегчит уничтожение рака. В этом и заключается задача нового препарата.
Сообщается, что недавно завершилась вторая фаза клинических испытаний селинексора с участием 83 пациентов, которым не помогли другие противораковые препараты. Добровольцы получали 80 миллиграммов селинексора и 20 миллиграммов дексаметазона в форме таблеток два раза в неделю. Лекарство оказалось эффективным более чем в 25% случаев.
Испытания также показали, что селинексор работает вне зависимости от предыдущего лечения. Его эффективность не зависит и от того, насколько агрессивен рак и насколько высок генетический риск развития онкологии.
Тем не менее важнейшее условие, с которым FDA одобряет дальнейшие испытания препарата, заключается в том, что он должен назначаться лишь в том случае, если четыре и более существующих схем лечения множественной миеломы оказались безуспешными.
Такое ограничение объясняется тем, что применение селинексора сопряжено с определёнными рисками. Препарат может влиять не только на раковые, но и на здоровые клетки - нарушать их способность транспортировать белки внутрь и наружу. Это может привести к осложнениям, таким как уменьшение количества тромбоцитов, эритроцитов или лейкоцитов.
Так, во второй фазе клинических испытаний как минимум у 20% пациентов побочные эффекты включали тромбоцитопению, анемию и лейкопению (снижение количества тромбоцитов, эритроцитов и лейкоцитов, соответственно), а также усталость, тошноту, снижение аппетита и веса, диарею, рвоту, одышку и инфекции верхних дыхательных путей.
Эксперты, проводящие клинические испытания, считают, что условие FDA оправданно и выдвинуто в соответствии с рисками. Селинексор по сути станет препаратом "последней надежды", то есть средством, которое можно применять лишь в крайнем случае - на том этапе лечения, когда более безопасные варианты не сработали.
О второй фазе клинических испытаний препарата подробнее рассказывается в статье, представленной в издании Journal of Clinical Oncology.
В настоящее время селинексор проходит третью фазу клинических испытаний. На этом этапе специалисты хотят проверить, насколько эффективной и безопасной окажется комбинация препарата в более низкой дозировке с другой противораковой терапией. В рамках других исследований учёные также проверяют возможность использования препарата для лечения лимфомы, лейкемии и саркомы.
Кстати, ранее "Вести.Наука" (nauka.vesti.ru) сообщали о других альтернативных способах борьбы с различными типами рака: в арсенале учёных появился очередной вирус, эффективный лекарственный дуэт, "лазер-убийца", вычищающий раковые клетки из крови, один из типов сахара и даже активный компонент глазных капель.
Источник