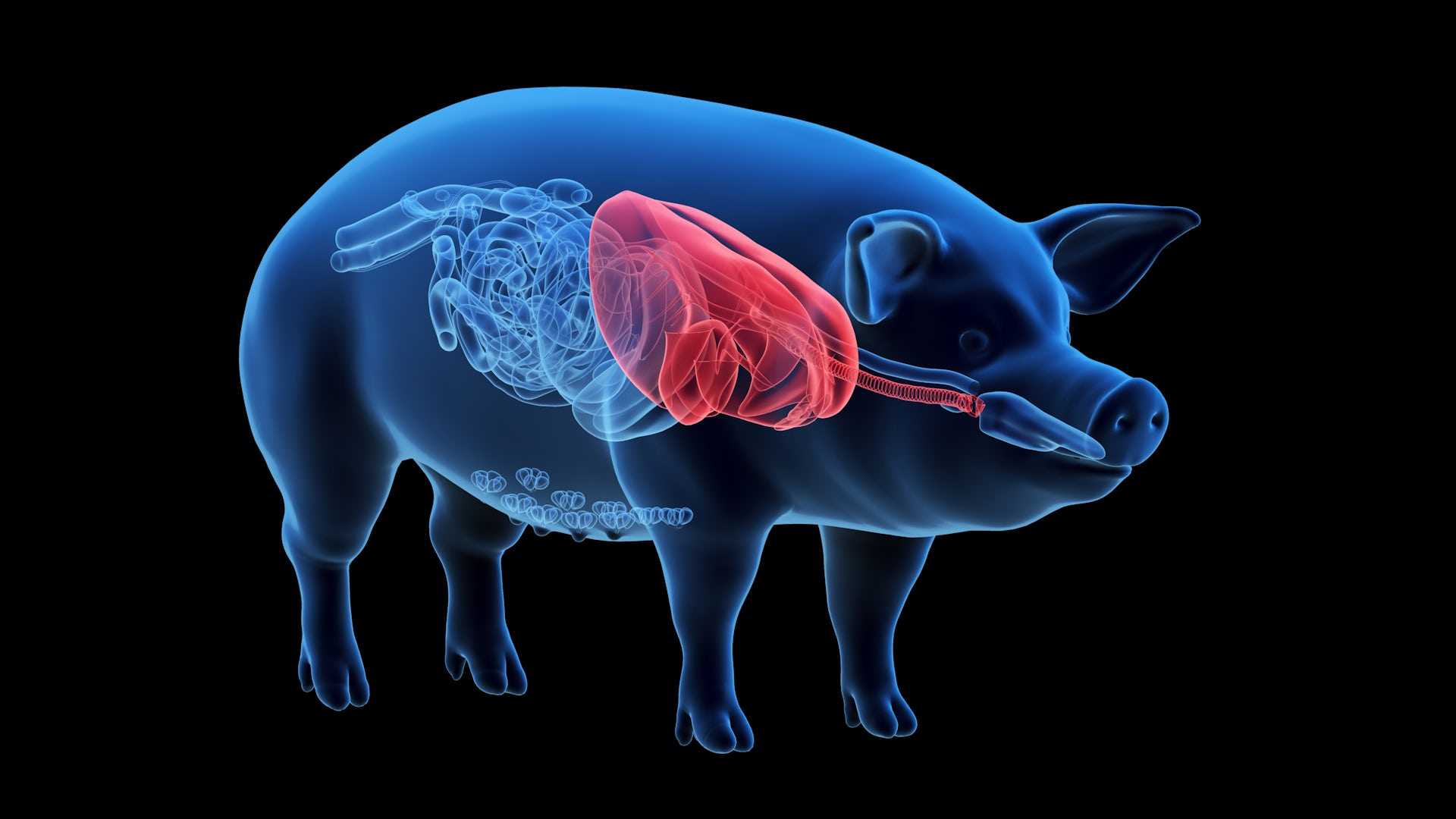
Свиная почка прижилась в макаках
О генетическом редакторе CRISPR-Cas9 мы подробно рассказывали три года назад, когда за него дали Нобелевскую премию. С его помощью можно выключить какой-нибудь ген или сделать его более активным, изменить последовательность определенного участка ДНК или просто вырезать из неё кусок.
Причём CRISPR-Cas9 позволяет проделывать всё это практически где угодно, на любом участке генома. Он более точен, чем другие генетические редакторы, и более удобен. Его использовали и на растениях, и на стволовых клетках, и на мухах, и на червях, и на рыбах с мышами. В каждой такой работе неизбежно говорится, что CRISPR-Cas9 в скором времени покинет мир научных лабораторий и станет элементом нашей повседневности. Нет нужды гадать, в какой именно повседневности нам предстоит с ним столкнуться - это медицина и, например, сельскохозяйственные биотехнологии.
На днях в Nature вышла статья сотрудников фармацевтической компании eGenesis с описанием свиных почек, которые благодаря CRISPR-Cas9 надолго прижилась в макаках-крабоедах. Разумеется, конечная цель здесь не макаки, а человек: мы периодически рассказываем о том, что есть идея выращивать в свиньях человеческие органы для пересадки. Подходящего донора-человека часто бывает трудно найти, свинья же всегда под рукой. Свиные органы подходят людям по размеру и важным физиологическим характеристикам. Однако генетически свиньи от нас весьма далеки, и если просто пересадить человеку что-то свиное, результатом будет мгновенная и тяжелейшая иммунная реакция.
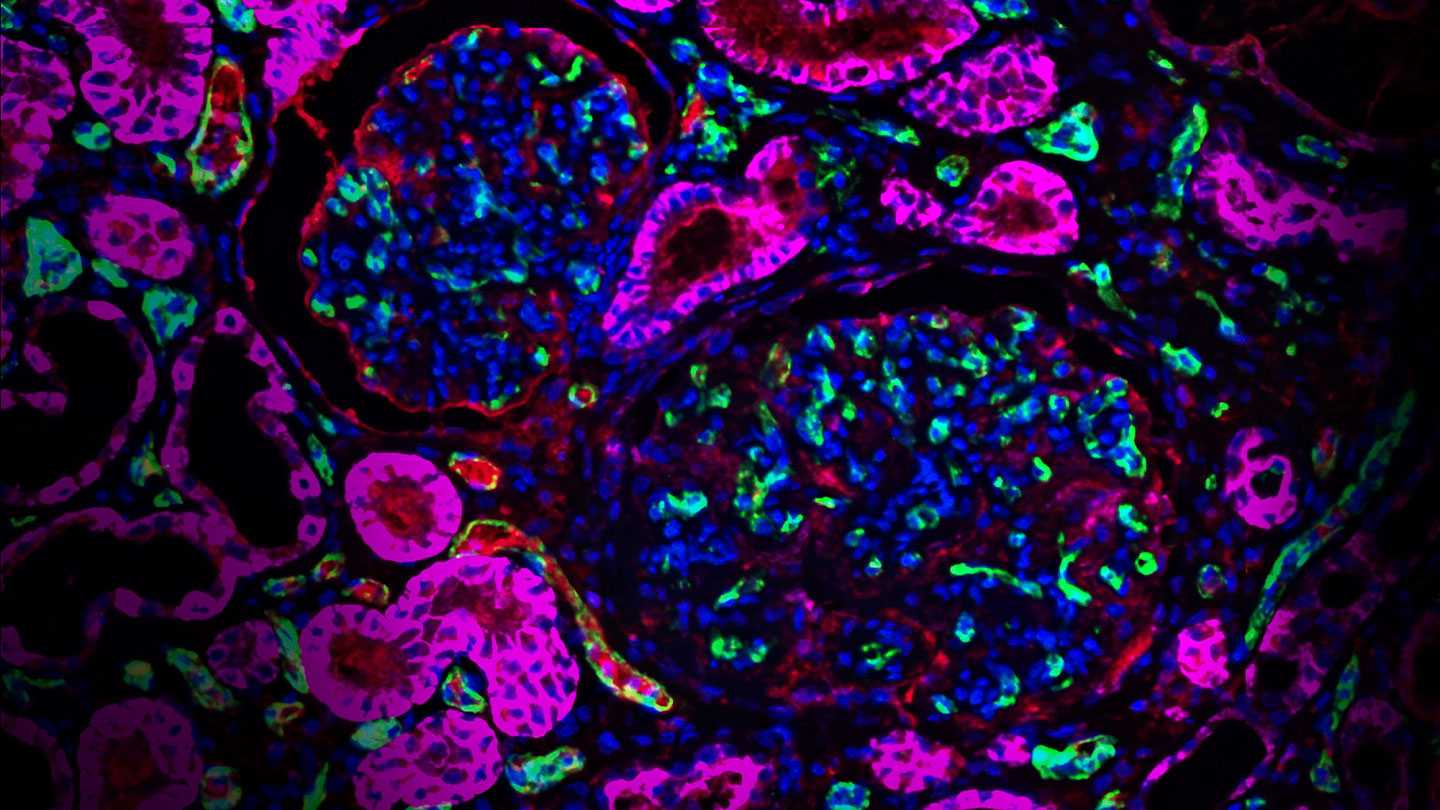
Срез почки ГМ-минипига. Флуоресцентные метки: зеленый цвет - эндотелиальные клетки CD31+; фуксия - человеческий белок CD46; красный - компонент системы комплемента C4d; синий - ядра клеток.
Чтобы решить проблему совместимости свиньи и человека, есть разные подходы. Например, можно создавать химерные свиночеловеческие органы, манипулируя зародышами свиньи и человеческими стволовыми клетками - об одной из таких работ мы недавно писали. Другой вариант - использовать генетический редактор CRISPR-Cas9. Этой идее уже много лет, более того, были эксперименты, в которых человеку пересаживали сердце от генетически модифицированной свиньи. Однако до сих пор не вполне понятно, насколько и как именно нужно модифицировать свинью.
У любой клетки есть молекулярный портрет из белков, липидов и углеводов, торчащих на её наружной мембране. Чужой иммунитет не обязательно бурно реагирует на все эти молекулы. Например, известно, что у свиных клеток есть три сложных углевода, на которые иммунитет приматов раздражается особенно сильно. В новых экспериментах со свиньями и макаками исследователи отключили три свиных гена, которые нужны для синтеза этих самых трёх углеводов. Ещё у свиней в геноме есть много копий эндогенного ретровируса PERV. Свиньям он не доставляет особых неудобств, но потенциально PERV вполне способен давать новые вирусные частицы, способные заражать человеческие клетки - пока что это видели только на клеточных культурах, однако лучше бы все копии PERV обезвредить заранее. Их и обезвредили - все 59 генов, соответствующих вирусу PERV, отключили с помощью того же CRISPR-Cas9.
Наконец, в геном свиней добавили семь человеческих генов, которые предотвращают тромбообразование в сосудах, уменьшают вероятность воспаления и вообще должны помогать пересаженному органу прижиться в новом организме. Генетические манипуляции производили не с обычными домашними свиньями, а с карликовыми, или, как их ещё называют, с минипигами. Орган из обычной свиньи продолжал бы активно расти в макаках и быстро превратился бы в настоящую проблему. Можно было бы, конечно, отключить и тот ген, который отвечает у обычных свиней за быстрый рост, но есть и другое решение - экспериментировать с минипигами.
Почки от генетически модифицированных минипигов пересаживали двадцати макакам. Обезьяны всё равно получали набор иммуносупрессоров: пусть свиные клетки лишили самых сильных молекулярных иммунных раздражителей, с ними всё равно остались остальные молекулы, на которые обезьяний иммунитет вполне мог бы отреагировать. (Хотя считается, что в идеале модифицированные органы вообще не должны будут вызывать никаких иммунных возмущений.) Выше говорилось про семь человеческих генов, которые должны облегчать приживаемость - их пересаживали не всем свиньям, и обезьяны, которые получали почки от таких свиней, жили не более 50 дней. А вот те макаки, которые получали почки с человеческими генами, прожили больше года, а одна так даже больше двух лет.
И хотя два года - это вполне прилично, такой разброс в выживаемости нельзя считать слишком большой удачей, потому что это значит, что трудно предсказать последствия всей процедуры. Как будет вести себя такая модифицированная почка в человеке, тоже трудно пока сказать: у человека и масса тела больше, и кровяное давление сильнее, чем у макак. Наконец, некоторые специалисты говорят, что в стольких генетических модификациях не было нужды, и схожего результата можно было добиться с меньшим вмешательством в свиной геном. Так или иначе, новые результаты говорят о том, что модифицированные органы для пересадки уже не такая фантастика, как могло показаться совсем недавно.
Вирус птичьего гриппа штамма H5N1
В другой статье, опубликованной в Nature Communications, речь идёт о курах - их с помощью того же CRISPR-Cas9 избавили от птичьего гриппа. От птичьего гриппа страдают не только птицы, но и люди, причём люди могут начать страдать особенно сильно - некоторые его штаммы могут заражать человека, и он вполне может стать причиной новой вирусной эпидемии, если ему повезёт с мутациями. Как и всякий вирус, он полагается на ресурсы заражённой клетки. В середине 2010-х у кур удалось найти белок ANP32A, который вирус птичьего гриппа использует в своих целях. В норме ANP32A помогает синтезировать РНК-копии на ДНК. Вирус гриппа - РНК-содержащий, то есть его геном зашифрован в РНК, и он, очевидно, нашёл способ размножаться с помощью ANP32A. У кур есть похожий белок ANP32B, но с ним вирус работать не может; также он не может работать с человеческими аналогами этих белков.
Очевидное решение - внести такие мутации в ген ANP32A, чтобы вирус не мог его использовать. Сотрудники Эдинбургского университета вместе с коллегами из Имперского колледжа Лондона так и сделали. Птенцы получились здоровыми, а когда их попытались специально заразить птичьим гриппом, это удалось сделать только с одним цыплёнком из десяти; причём от заражённой птицы вирус никому из модифицированных кур не передавался. В принципе, можно было заразить всех птиц с мутированным ANP32A, но тогда количество вируса нужно было повышать в тысячу раз против нормального. Да и тогда болезнь развивалась медленно, новых вирусных частиц появлялось не очень много, и заражать других модифицированных кур вирус всё равно не мог.
Правда, вирусы, как мы знаем, легко мутируют и поэтому умеют быстро обходить трудности. У тех вирусов, которым пришлось размножаться в курах с модификацией, появилась небольшая способность использовать мутированный ANP32A, и, кроме того, вирусы начали работать с вышеупомянутым вариантом белка ANP32А - белком ANP32B. Может быть, курам можно добавить генетических модификаций, которые сделают жизнь в них для птичьего гриппа совсем невыносимой. Но тут важно не переборщить: сами куры после модификаций должны оставаться здоровыми и способными нормально размножаться.
Автор: Кирилл Стасевич
Ссылка на источник

Причём CRISPR-Cas9 позволяет проделывать всё это практически где угодно, на любом участке генома. Он более точен, чем другие генетические редакторы, и более удобен. Его использовали и на растениях, и на стволовых клетках, и на мухах, и на червях, и на рыбах с мышами. В каждой такой работе неизбежно говорится, что CRISPR-Cas9 в скором времени покинет мир научных лабораторий и станет элементом нашей повседневности. Нет нужды гадать, в какой именно повседневности нам предстоит с ним столкнуться - это медицина и, например, сельскохозяйственные биотехнологии.
На днях в Nature вышла статья сотрудников фармацевтической компании eGenesis с описанием свиных почек, которые благодаря CRISPR-Cas9 надолго прижилась в макаках-крабоедах. Разумеется, конечная цель здесь не макаки, а человек: мы периодически рассказываем о том, что есть идея выращивать в свиньях человеческие органы для пересадки. Подходящего донора-человека часто бывает трудно найти, свинья же всегда под рукой. Свиные органы подходят людям по размеру и важным физиологическим характеристикам. Однако генетически свиньи от нас весьма далеки, и если просто пересадить человеку что-то свиное, результатом будет мгновенная и тяжелейшая иммунная реакция.

Срез почки ГМ-минипига. Флуоресцентные метки: зеленый цвет - эндотелиальные клетки CD31+; фуксия - человеческий белок CD46; красный - компонент системы комплемента C4d; синий - ядра клеток.
Чтобы решить проблему совместимости свиньи и человека, есть разные подходы. Например, можно создавать химерные свиночеловеческие органы, манипулируя зародышами свиньи и человеческими стволовыми клетками - об одной из таких работ мы недавно писали. Другой вариант - использовать генетический редактор CRISPR-Cas9. Этой идее уже много лет, более того, были эксперименты, в которых человеку пересаживали сердце от генетически модифицированной свиньи. Однако до сих пор не вполне понятно, насколько и как именно нужно модифицировать свинью.
У любой клетки есть молекулярный портрет из белков, липидов и углеводов, торчащих на её наружной мембране. Чужой иммунитет не обязательно бурно реагирует на все эти молекулы. Например, известно, что у свиных клеток есть три сложных углевода, на которые иммунитет приматов раздражается особенно сильно. В новых экспериментах со свиньями и макаками исследователи отключили три свиных гена, которые нужны для синтеза этих самых трёх углеводов. Ещё у свиней в геноме есть много копий эндогенного ретровируса PERV. Свиньям он не доставляет особых неудобств, но потенциально PERV вполне способен давать новые вирусные частицы, способные заражать человеческие клетки - пока что это видели только на клеточных культурах, однако лучше бы все копии PERV обезвредить заранее. Их и обезвредили - все 59 генов, соответствующих вирусу PERV, отключили с помощью того же CRISPR-Cas9.
Наконец, в геном свиней добавили семь человеческих генов, которые предотвращают тромбообразование в сосудах, уменьшают вероятность воспаления и вообще должны помогать пересаженному органу прижиться в новом организме. Генетические манипуляции производили не с обычными домашними свиньями, а с карликовыми, или, как их ещё называют, с минипигами. Орган из обычной свиньи продолжал бы активно расти в макаках и быстро превратился бы в настоящую проблему. Можно было бы, конечно, отключить и тот ген, который отвечает у обычных свиней за быстрый рост, но есть и другое решение - экспериментировать с минипигами.
Почки от генетически модифицированных минипигов пересаживали двадцати макакам. Обезьяны всё равно получали набор иммуносупрессоров: пусть свиные клетки лишили самых сильных молекулярных иммунных раздражителей, с ними всё равно остались остальные молекулы, на которые обезьяний иммунитет вполне мог бы отреагировать. (Хотя считается, что в идеале модифицированные органы вообще не должны будут вызывать никаких иммунных возмущений.) Выше говорилось про семь человеческих генов, которые должны облегчать приживаемость - их пересаживали не всем свиньям, и обезьяны, которые получали почки от таких свиней, жили не более 50 дней. А вот те макаки, которые получали почки с человеческими генами, прожили больше года, а одна так даже больше двух лет.
И хотя два года - это вполне прилично, такой разброс в выживаемости нельзя считать слишком большой удачей, потому что это значит, что трудно предсказать последствия всей процедуры. Как будет вести себя такая модифицированная почка в человеке, тоже трудно пока сказать: у человека и масса тела больше, и кровяное давление сильнее, чем у макак. Наконец, некоторые специалисты говорят, что в стольких генетических модификациях не было нужды, и схожего результата можно было добиться с меньшим вмешательством в свиной геном. Так или иначе, новые результаты говорят о том, что модифицированные органы для пересадки уже не такая фантастика, как могло показаться совсем недавно.

Вирус птичьего гриппа штамма H5N1
В другой статье, опубликованной в Nature Communications, речь идёт о курах - их с помощью того же CRISPR-Cas9 избавили от птичьего гриппа. От птичьего гриппа страдают не только птицы, но и люди, причём люди могут начать страдать особенно сильно - некоторые его штаммы могут заражать человека, и он вполне может стать причиной новой вирусной эпидемии, если ему повезёт с мутациями. Как и всякий вирус, он полагается на ресурсы заражённой клетки. В середине 2010-х у кур удалось найти белок ANP32A, который вирус птичьего гриппа использует в своих целях. В норме ANP32A помогает синтезировать РНК-копии на ДНК. Вирус гриппа - РНК-содержащий, то есть его геном зашифрован в РНК, и он, очевидно, нашёл способ размножаться с помощью ANP32A. У кур есть похожий белок ANP32B, но с ним вирус работать не может; также он не может работать с человеческими аналогами этих белков.
Очевидное решение - внести такие мутации в ген ANP32A, чтобы вирус не мог его использовать. Сотрудники Эдинбургского университета вместе с коллегами из Имперского колледжа Лондона так и сделали. Птенцы получились здоровыми, а когда их попытались специально заразить птичьим гриппом, это удалось сделать только с одним цыплёнком из десяти; причём от заражённой птицы вирус никому из модифицированных кур не передавался. В принципе, можно было заразить всех птиц с мутированным ANP32A, но тогда количество вируса нужно было повышать в тысячу раз против нормального. Да и тогда болезнь развивалась медленно, новых вирусных частиц появлялось не очень много, и заражать других модифицированных кур вирус всё равно не мог.
Правда, вирусы, как мы знаем, легко мутируют и поэтому умеют быстро обходить трудности. У тех вирусов, которым пришлось размножаться в курах с модификацией, появилась небольшая способность использовать мутированный ANP32A, и, кроме того, вирусы начали работать с вышеупомянутым вариантом белка ANP32А - белком ANP32B. Может быть, курам можно добавить генетических модификаций, которые сделают жизнь в них для птичьего гриппа совсем невыносимой. Но тут важно не переборщить: сами куры после модификаций должны оставаться здоровыми и способными нормально размножаться.
Автор: Кирилл Стасевич
Ссылка на источник